题目内容
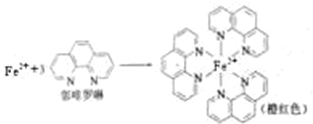
已知:测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:4FeCl3+2NH2OH?HCl=4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式 .
②羟胺(NH2OH)中N原子的杂化方式
(2)硫酸铜晶体的化学式也可以表达为 Cu(H2O)4SO4?H2O晶体,该晶体中含有的化学键类型是 .
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等.其中元素P、As、Se第一电离能由小到大的顺序为: .
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(4)基态Ni外围电子排布图为 ,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 ;
(5)已知CrO5中Cr为+6价,则CrO5的结构式为 .
①Fe2+在基态时,价层电子排布式
②羟胺(NH2OH)中N原子的杂化方式
(2)硫酸铜晶体的化学式也可以表达为 Cu(H2O)4SO4?H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等.其中元素P、As、Se第一电离能由小到大的顺序为:
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(4)基态Ni外围电子排布图为
(5)已知CrO5中Cr为+6价,则CrO5的结构式为

考点:原子核外电子排布,根据化合价正确书写化学式(分子式),元素电离能、电负性的含义及应用,化学键,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)①Fe基态原子外围电子排布式为3d64s2,铁原子失去4s上的2个电子变成Fe2+,Fe2+在基态时,价层电子排布式为3d6;
②羟胺(NH2OH)中N原子形成3个σ键,一个孤电子对,因此N采取sp3杂化;
(2)阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
(3)同一周期,从左到右,元素的第一电离呈增大趋势,但第VA族元素第一电离能大于第VIA元素,同一主族,从上到下,元素的第一电离逐渐减小;
(4)Ni是28号元素,外围电子排布式为3d84s2,基态Ni外围电子排布图为 ;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
(5)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式.
②羟胺(NH2OH)中N原子形成3个σ键,一个孤电子对,因此N采取sp3杂化;
(2)阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
(3)同一周期,从左到右,元素的第一电离呈增大趋势,但第VA族元素第一电离能大于第VIA元素,同一主族,从上到下,元素的第一电离逐渐减小;
(4)Ni是28号元素,外围电子排布式为3d84s2,基态Ni外围电子排布图为
 ;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;(5)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式.
解答:
解:(1)①Fe基态原子外围电子排布式为3d64s2,铁原子失去4s上的2个电子变成Fe2+,Fe2+在基态时,价层电子排布式为3d6,
故答案为:3d6;
②羟胺(NH2OH)中N原子形成3个σ键,一个孤电子对,因此N采取sp3杂化,
故答案为:sp3;
(2)Cu(H2O)4SO4?H2O中硫酸根离子和Cu(H2O)42+存在离子键,O原子和铜原子之间存在配位键,H2O中H和O之间存在共价键,所以Cu(H2O)4SO4?H2O中所含的化学键有共价键、离子键、配位键;
故答案为:共价键、离子键、配位键;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,同一主族,从上到下,元素的第一电离逐渐减小,所以第一电离能As<P,则第一电离能:Se<As<P;
故答案为:Se<As<P;
(4)Ni是28号元素,外围电子排布式为3d84s2,基态Ni外围电子排布图为 ;第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,
;第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,
故答案为: ;C;
;C;
(5)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为 ,
,
故答案为: .
.
故答案为:3d6;
②羟胺(NH2OH)中N原子形成3个σ键,一个孤电子对,因此N采取sp3杂化,
故答案为:sp3;
(2)Cu(H2O)4SO4?H2O中硫酸根离子和Cu(H2O)42+存在离子键,O原子和铜原子之间存在配位键,H2O中H和O之间存在共价键,所以Cu(H2O)4SO4?H2O中所含的化学键有共价键、离子键、配位键;
故答案为:共价键、离子键、配位键;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,同一主族,从上到下,元素的第一电离逐渐减小,所以第一电离能As<P,则第一电离能:Se<As<P;
故答案为:Se<As<P;
(4)Ni是28号元素,外围电子排布式为3d84s2,基态Ni外围电子排布图为
 ;第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,
;第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,故答案为:
 ;C;
;C;(5)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为
 ,
,故答案为:
 .
.
点评:本题考查较为综合,涉及电子排布式(图)、结构式、化学键类型、电离能比较、杂化类型的判断等知识,难度中等,本题易错点为(4),注意把握提干要求.

练习册系列答案
相关题目
普罗加比对瘫痫、痉挛和运动失调均有良好的治疗效果,其结构如图所示,有关普罗加比的说法正确的是( )
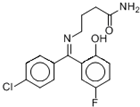

| A、该分子在1H核磁共振谱中有12个峰 |
| B、久置在空气中的普罗加比会因氧化而变质 |
| C、1 mol普罗加比最多可与3 mol NaOH反应 |
| D、一定条件下,1mol普罗加比最多能与2mol H2发生加成反应 |
某化学兴趣小组把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀A生成.再过滤,加热至恒重得到B.对物质A、B该小组有如下四种判断,你认为正确的是( )
| A、Fe(OH)3; Fe2O3 |
| B、Fe(OH)2; FeO |
| C、Fe(OH)3、Fe(OH)2;Fe3O4 |
| D、Fe2O3;Fe(OH)3 |
下列各组烃的混合物,只要总质量一定,按任意比例混合,完全燃烧后生成的CO2和H2O都是恒量的是( )
| A、C2H2、C2H4 |
| B、C2H4、C4H6 |
| C、C2H6、C3H6 |
| D、C6H6、C2H2 |
化学与社会、生产、生活密切相关.下列说法正确的是( )
| A、加快化石燃料的开采和使用 |
| B、NaHCO3可用于治疗胃酸过多 |
| C、明矾可用于水的杀菌消毒 |
| D、从海水中提取物质都必须通过化学反应才能实现 |
表示下列用途或变化的离子方程式不正确的是( )
| A、泡沫灭火器灭火原理:Al3++3HCO3-=3CO2↑+Al(OH)3↓ |
| B、纯碱代替洗涤剂洗涤餐具:CO32-+H2O?HCO3-+OH- |
| C、明矾净水原理:Al3++3H2O?Al(OH)3+3H+ |
| D、NaHCO3的水解:HCO3-+H2O?H3O++CO32- |