题目内容
17.下列说法正确的是( )| A. | 元素周期表中有7个主族,7个副族,共14个纵行 | |
| B. | 氮元素位于第二周期第三主族 | |
| C. | 金属性最强的元素是Li | |
| D. | 非金属性最强的元素是F |
分析 A.周期表中共18个纵行,8、9、10三个纵行为Ⅷ族;
B.氮元素是7号元素,最外层5个电子;
C、金属性最强的元素在元素周期表的左下角;
D、非金属性最强的元素在元素周期表的右上角(0族元素除外).
解答 解:A.周期表中共18个纵行,8、9、10三个纵行为Ⅷ族,还有7个主族,7个副族,1个零族,故A错误;
B.氮元素是7号元素,最外层5个电子,所以氮元素位于第二周期第ⅤA族,故B错误;
C、金属性最强的元素是Cs,故C错误;
D、非金属性最强的元素是F,故D正确;
故选D.
点评 本题考查元素周期律的应用,题目难度不大,注意把握元素周期表的结构、规律以及应用.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
7.下列说法不正确的是( )
| A. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 | |
| B. | 0.1 mol•L-1醋酸溶液中:c2(H+)=c(H+)•c(CH3COO-)+KW | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)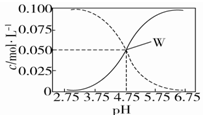 | |
| D. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
8.酸雨的水溶液的pH值范围是( )
| A. | pH小于7 | B. | pH小于5.6 | C. | pH大于5.6 | D. | pH小于0 |
5.下列离子方程式书写正确的是( )
| A. | 三氧化硫溶于水:SO3+H2O=SO42-+2H+ | |
| B. | 氯气溶于水:Cl2+H2O=2H++ClO-+Cl- | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 大理石与稀盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
12.常温下,NaHCO3溶液呈弱碱性.下列关于0.10mol•L-1NaHCO3溶液的说法正确的是( )
| A. | 加水稀释,HCO3-?H++CO32-平衡右移,溶液中氢离子浓度减小 | |
| B. | 加水稀释后,碳酸氢根离子水解平衡向右移动,溶液中氢氧根离子浓度减小 | |
| C. | 加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| D. | 温度升高,c(HCO3-)增大 |
2.常温下,在水中加入(或通入)少量下列物质,水电离的c(H+)•c(OH-)会增大的是( )
| A. | HCl | B. | NaCl | C. | Na2CO3 | D. | Na2O2 |
9.对已经达到衡的下列反应;2X(g)+Y(g)?2Z(g)减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆速率都增大,平衡向正反应方向移动 |
9.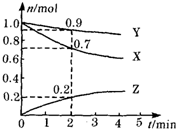 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )| A. | X+3Y=2Z 0.1mol•min-1 | B. | 2X+Y?2Z 0.1mol•min-1 | ||
| C. | X+2Y=Z 0.05mol•min-1 | D. | 3X+Y?2Z 0.05mol•min-1 |
10.如图为元素周期表短周期的一部分.E原子的电子层数为n,最外层电子数为2n+l.下列叙述不正确的是( )
| A | B | C | |
| D | E |
| A. | A与B形成的阴离子可能有AB32-、A2B42- | |
| B. | AD2分子中每个原子的最外层均为8电子结构 | |
| C. | C和E氢化物的热稳定性和还原性均依次减弱 | |
| D. | A、D、E的最高价氧化物对应的水化物的酸性依次增强 |