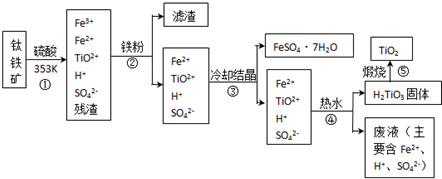
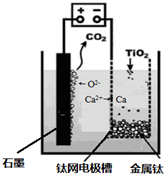
题目内容
(6分)在MnO2 + 4HCl (浓)△="== " MnCl2 + Cl2↑+ 2H2O的反应中,用“双线桥法”表示氧化还原反应中电子转移情况;还原剂是________,氧化产物是______,该反应的离子方程式为____________________________________________
(6分)MnO2 + 4HCl (浓)△="== " MnCl2 + Cl2↑+ 2H2O(双线桥标注)略
还原剂是HCl,氧化产物是Cl2_,离子方程式为MnO2 +4H++ 2Cl-(浓)△===Mn2++ Cl2↑+ 2H2O
解析

练习册系列答案
相关题目
 A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:
A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应: 根据如图的转化关系完成下列有关问题:
根据如图的转化关系完成下列有关问题: