题目内容
3.下列情况中能用勒夏特列原理解释的有( )①实验室常用饱和NaHCO3溶液除去CO2中混有的SO2
②长时间存放的氯水,会变为无色透明
③合成氨工业中用铁触媒做催化剂
④K2Cr2O7溶液中滴加NaOH溶液后颜色变为黄色
⑤将二氧化氮和四氧化二氮的混合气体置于密闭容器中浸入热水,容器中气体颜色变深
⑥将装有硫代硫酸钠溶液与稀硫酸的混合液的容器浸入热水,溶液中迅速产生混浊物
⑦在醋酸溶液中,加入一些醋酸钠固体使溶液的PH增大.
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 全部 |
分析 勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动. 勒夏特列原理是指在一个平衡体系中,若改变影响平衡的一个条件,平衡总是要向能够减弱这种改变的方向移动.比如一个可逆反应中,当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少;但这种减弱不可能消除增加反应物浓度对这种反应物本身的影响,与旧的平衡体系中这种反应物的浓度相比而言,还是增加了.
解答 解:①实验室常用饱和NaHCO3溶液除去CO2中混有的SO2气体,溶液中存在二氧化碳的溶解平衡,碳酸氢根降低了二氧化碳的溶解度,可以用勒夏特列原理解释,故正确;
②氯水在溶液中存在溶解平衡,长期放置、次氯酸分解,平衡正向移动,最终成为盐酸,可以用勒夏特列原理解释,故正确;
③催化剂只是影响反应速率,不能用勒夏特列原理解释,故错误;
④在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq),故能够用勒夏特列原理解释,故正确;
⑤二氧化氮和四氧化二氮混合气体的密闭容器置于热水中,化学平衡向着生成二氧化氮的方向进行,颜色变深,能用勒夏特利原理解释,故正确;
⑥将装有Na2S2O3溶液与稀硫酸混合液的容器浸入热水中,发生氧化还原反应生成二氧化硫和单质硫,不能用勒夏特列原理解释,故B错误;
⑦在醋酸溶液中存在电离平衡,加入一些醋酸钠固体,抑制醋酸的电离,所以溶液的pH增大,能用勒夏特列原理解释,故正确;
能用勒夏特列原理解释的是:①②④⑤⑦;
故选B.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

| A. | 玻璃棒下端要靠在三层滤纸处 | |
| B. | 滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡 | |
| C. | 过滤时将液体沿玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| D. | 漏斗下端紧靠烧杯内壁 |
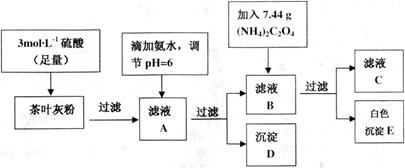
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;
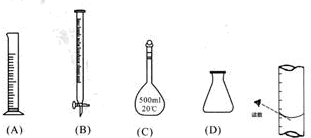
②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④0.1NA硫酸分子与8.8g CO2含有相同的氧原子数
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,22.4L水所含分子数为NA
⑦17g氨气所含电子数目为10NA.
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
| A. | 碳酸钠溶液 | B. | 酚酞试液 | C. | 石蕊试液 | D. | 氯化钡溶液 |




 ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应. )与乙醇(
)与乙醇( )反应生成酯(
)反应生成酯( )和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式:
)和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式: +CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.
+CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.