题目内容
9.欲使明矾溶液中的Al3+完全沉淀下来,适宜的试剂是( )| A. | NaOH | B. | 盐酸 | C. | 氨水 | D. | 氯化钡溶液 |
分析 氢氧化铝溶于强碱溶液,欲使明矾溶液中的Al3+完全沉淀下来,应该加入弱碱,如氨水,据此进行解答.
解答 解:A.氢氧化钠能够溶解氢氧化铝,欲使明矾溶液中的Al3+完全沉淀下来,无法控制加入NaOH的量,故A错误;
B.盐酸不与铝离子反应,故B错误;
C.铝离子与氨水反应生成氢氧化铝沉淀,反应方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,可以用氨水将铝离子完全沉淀,故C正确;
D.氯化钡不与硫离子反应,故D错误;
故选C.
点评 本题考查了元素化合物性质,题目难度不大,明确常见元素及其化合物性质为解答关键,注意氢氧化铝为两性氢氧化物,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
17.根据所学规律,你认为下列物质在水中溶解度较大的是( )
| A. | 甲烷 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 氢气 |
4.1-丙醇蒸气与空气混合通过加热的铜网,生成一种化合物,与该化合物互为同分异构体的是( )
①CH3CH2OCH3
②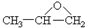
③CH3OOCCH3
④CH3COCH3
⑤CH3CHOHCH3.
①CH3CH2OCH3
②

③CH3OOCCH3
④CH3COCH3
⑤CH3CHOHCH3.
| A. | ①③ | B. | ①⑤ | C. | ②④ | D. | ①④ |
1.元素性质呈现周期性变化的本质原因是( )
| A. | 相对原子质量逐渐增大 | B. | 原子核外电子排布呈现周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素的化合价呈现周期性变化 |
18.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后溶液稀释至1L,测得溶液的pH=1,下列叙述错误的是( )
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2与H2的体积比为5:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移电子3mol |
19.除去FeCl2溶液中混有的少量FeCl3,应选用的最佳试剂是( )
| A. | 氯水 | B. | 氢氧化钠溶液 | C. | 铜粉 | D. | 铁粉 |



 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: