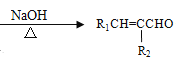
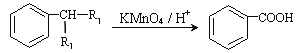题目内容
【题目】A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______。
(2)在1mol DC2中,有___mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____(填元素符号),三种10e-的化合物中沸点最低的___。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________。
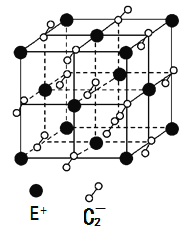
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
【答案】 4 12 C<O<N (N>O>C) CH4 AD
4 12 C<O<N (N>O>C) CH4 AD
【解析】
B、D两种元素原子的最外层电子数是最内层电子数的两倍,则B的核外电子排布是2、4,是C元素;D的核外电子排布是2、8、4,是Si元素;C原子序数大于6,而且C元素原子的最外层电子数等于B元素原子的核外电子数,则C的核外电子排布是2、6,是O元素;E的价电子数为1原子序数大于Si。则E为K元素。
(1)O元素的原子结构示意图为 ;
;
(2)SiO2是原子晶体,每个Si原子与4个O原子形成4个Si—O共价键。所以在1moSiO2中,有4mol Si—O键;
(3)CO2在固态时是分子晶体,其晶体类型为立方面心结构。所以在每个晶胞中与它距离最近的CO2分子的个数为3个,通过一个CO2可以形成8个晶胞,而且每个CO2都重复了2次,所以在化合物CO2的晶体中,每个CO2分子周围与它距离最近的CO2分子有(8×3)÷2=12;
(4)由于元素X原子序数介于B、C之间,所以X是N元素。它与C、O都可与与A形成的10e-的化合物。由于A的原子序数小于6 ,则A为H元素。一般情况下,原子序数越大,元素的电负性越大,元素的第一电离能就越大。但是由于N原子核外的电子排布处于半充满的稳定状态,所以去第一电离能比O还要大些。因此C、N、O三元素的第一电离能大小关系为:N>O>C或C<O<N。三种元素形成的10e-的化合物是CH4、NH3、H2O。由于N、O电负性大,原子半径小,所以在NH3、H2O的分子之间除了存在分子间作用力外还存在氢键,而CH4的分子之间只存在分子间作用力。因此甲烷的沸点最低;
(5)A.由晶胞结构示意图可知:在该晶胞中含有K+:8×1/8+6×1/2=4;O2-:1+12×1/4=4.所以K+:O2-=1:1;在一个晶胞中含有KO2,正确;
B.晶体中每个E+周围有6个O2-,每个C2-周围有6个K+,错误;
C.晶体中与每个E+距离最近的E+有(8×3)÷2=12个,错误;
D.在晶体中,假设0价O为x,-2价O为y。则x+y=2;0+(-2)y=-1.解得x=3/2,y=1/2,所以0价O与-2价O的数目比为3:1,正确;
E.O2-电子数为17,与N2电子数为14.所以二者不能互为等电子体,错误。

【题目】钴及其化合物可应用与催化剂、电池、颜料与染料等。
(1)CoO是一种油漆添加剂,可通过反应①②制备。
①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1
②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1
则反应2Co(s)+O2(g)+2CO2(g)=2CoO3(s) 的ΔH=_________。
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极的电极反应式为_________,Li+向______移动(填“正极”或“负极“)。
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4。该反应的化学方程式为___________________。
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图-1所示,该循环的总反应方程式为_________________(反应条件无需列出)

(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx。不同温度下,将10mol模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图-2所示.
模拟尾气 | 气体 | 碳烟 | ||
NO | O2 | He | ||
物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |

①380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为__________________。
②实验过程中采用NO模拟NOx,,而不采用NO2的原因是______________________。