题目内容
4.NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 10 gH218O含有的中子数为5NA | |
| B. | 标准状况下,2.24LCH2Cl2含有的分子数为0.l NA | |
| C. | 1 mol氯气参加反应时,电子转移数目一定为2NA | |
| D. | 常温下,pH=6的纯水中OH-的数目为10-8NA |
分析 A.H218O分子中含有10个中子,其摩尔质量为20g/mol;
B.标况下CH2Cl2的状态气体;
C.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂又是还原剂,1mol氯气完全反应转移1mol电子;
D.缺少水的体积,无法计算含有氢氧根离子数目.
解答 解:A.10 gH218O的物质的量为:$\frac{10g}{20g/mol}$=0.5mol,0.5mol该水分子中含有中子的物质的量为:0.5mol×10=5mol,含有的中子数为5NA,故A正确;
B.标准状况下CH2Cl2不是气体,不能使用标况下的气体摩尔体积计算,故B错误;
C.1mol氯气与NaOH溶液反应生成氯化钠和次氯酸钠,氯气既是氧化剂又是还原剂,转移了1mol电子,电子转移数目为NA,故C错误;
D.没有告诉水的体积,无法计算含有氢氧根离子的物质的量及数目,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
14.下面列出了电解不同物质的电极反应式,其中错误的是( )
| A. | 以惰性电极电解饱和食盐水阴极:Na++e-═Na | |
| B. | 用铜电极电解CuSO4溶液)阳极:Cu═Cu2++2e- | |
| C. | 以惰性电极电解熔融NaCl阴极:Na++e-═Na | |
| D. | 以惰性电极电解NaOH溶液阳极:4OH-═2H2O+O2↑+4e- |
15.X、Y、Z三种元素都是短周期的主族元素.X是同周期主族元素中原子半径最大的元素;Y元素的原子的最外层电子数是其所在周期数的二倍;Z元素原子的最外层电子数是其所在周期数的三倍.下列有关叙述中正确的是( )
| A. | 用惰性电极电解由X、Y、Z形成的化合物的水溶液,电解后溶液的pH值一定增大 | |
| B. | 由X、Y、Z形成的化合物的分子式一定为X2YZ3 | |
| C. | 由X、Y、Z形成的化合物的水溶液可能呈酸性、中性或碱性 | |
| D. | X元素形成的单质晶体可能为金属晶体,Y、Z两元素形成的单质晶体一定为分子晶体 |
12.海洋中有丰富的食品、矿产、能源、药物和水产等资源,如图表示海水综合利用的部分过程.下列说法不正确的是( )
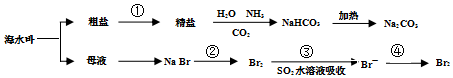

| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第②、④步骤中,溴元素均被氧化 | |
| D. | 制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质 |
9.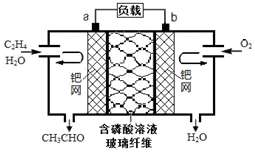 乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
 乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )
乙烯直接氧化法制乙醛的总反应方程式为2CH2═CH2+O2$\stackrel{PdCl_{2}•CuCl_{2}}{→}$2CH3CHO.下列有关说法正确的是( )| A. | 该电池可实现化学能与电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 放电时,电路中每转移0.4mol电子,溶液中就有0.4molH+向负极迁移 | |
| D. | 该电池的负极反应式为:CH2═CH2-2e-+H2O=CH3CHO+2H+ |
16.有机物的结构可用“键线式”表示,下列有关键线式为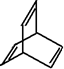 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )
 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为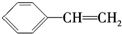 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |