题目内容
6.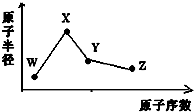 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.下列判断正确的是( )
①W在元素周期表位置是二周期ⅦA族
②Y的氢化物是正四面体结构
③X的氢化物可以用来腐蚀玻璃
④Z的最高价氧化物对应的水化物酸性比Y的强
⑤Y单质的另一重要用途是做光导纤维
⑥W、X、Y形成的化合物是制备木材防火剂的原料.
| A. | ②④⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②④ |
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;Y的原子半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是Si元素;Z的非金属性在同周期元素中最强,原子序数大于Si,故Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,可知W的质子数为8,则W是氧元素;X和Ne原子的核外电子数相差1,且原子半径比W大,可知X为11号元素,故X为Na元素;Y的原子半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是Si元素;Z的非金属性在同周期元素中最强,原子序数大于Si,故Z为Cl元素.
①W为O元素,在元素周期表位置是二周期VIA族,故错误;
②Y的氢化物为SiH4,是正四面体结构,故正确;
③X的氢化物为NaH,用来腐蚀玻璃为HF,故错误;
④Z的最高价氧化物对应的水化物为高氯酸,酸性比Y的强,故正确
⑤二氧化硅用于做光导纤维,故错误;
⑥W、X、Y形成的化合物为硅酸钠,硅酸钠溶液是无机矿物胶,是制备木材防火剂的原料,故正确,
故选:A.
点评 本题考查结构性质位置关系应用,关键是根据原子半径与原子序数确定元素,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是( )
| A. | 硫酸 | B. | 氢氟酸 | C. | 碳酸钠溶液 | D. | 氢氧化钠溶液 |
17.下列物质属于电解质的是( )
| A. | 熔融的NaOH | B. | 氨气 | C. | 蔗糖 | D. | KCl溶液 |
1.下列物质的包装上贴错了危险警告标签的是( )
| A. |  | B. |  | C. |  | D. |  |
11.美国研究人员在《科学》杂志上发表论文称,他们开发出了一直新的固体氧化物燃料电池,在用碳氢化合物-异辛烷作燃料时,能源转化效率达50%,电解质为熔融的氧化物,能传导O2-,这种新型燃料电池经过更多试验后,能广泛应用于汽车、飞机等,下列关于该电池的说法正确的是( )
| A. | 该电池的正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 该电池的负极反应为:C8H18+25O2--50e-═8CO2↑+9H2O | |
| C. | 电解质的作用是传递电子 | |
| D. | 电池中阴离子向正极移动 |
18.N2和O2在一定条件下发生化合反应生成气体B,反应掉N2体积是反应掉O2体积的两倍(同温同压).则B分子的组成是( )
| A. | N2O | B. | NO | C. | NO2 | D. | N2O4 |
15.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |||||||||||
| C. | 已知:
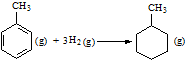 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
16.下列关于溶液中离子的说法正确的是( )
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量盐酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
