题目内容
12.已知:①1mol某链烃最多能与1molHCl发生加成反应,生成1mol氯代烷;②1mol该氯代烷能与7molCl2发生取代反应,生成只含碳、氯的氯代烷.该烃可能是( )| A. | CH3CH=CH2 | B. | CH2=CHCH=CH3 | C. | CH3CH=CHCH3 | D. | CH2=CH2 |
分析 1mol某链烃最多能和1molHCl发生加成反应,则分子含有1个C=C键;1mol该卤代烷能和7molCl2发生取代反应,生成只含碳元素和氯元素的氯代烃,卤代烃分子中含有7个H原子,其中1个H原子为链烃与HCl发生加成反应引入,所以链烃分子中含有6个H原子,据此结合选项判断.
解答 解:①1mol某链烃最多能和1molHCl发生加成反应,则该烃分子含有1个C=C键;
②1mol该卤代烷能和7molCl2发生取代反应,生成只含碳元素和氯元素的氯代烃,卤代烃分子中含有7个H原子,其中1个H原子为链烃与HCl发生加成反应引入,所以链烃分子中含有6个H原子,
根据分析可知,该烃分子中含有1个碳碳双键、6个H原子,选项中只有CH3CH=CH2符合,
故选A.
点评 本题考查了有机物分子式确定,题目难度中等,明确取代反应、加成反应原理为解答关键,注意熟练掌握常见有机物结构与性质,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
17.下列醇中能催化氧化成醛的是( )
| A. | (CH3)2CHOH | B. | (CH3)2C(C2H5)OH | C. | (CH3)3CCH2OH | D. | CH3C(C2H5)2OH |
3.科学家发现铂的两种化合物a和b,结构简式分别为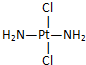 和
和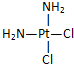 ,a具有抗癌作用而b没有,则两者互为( )
,a具有抗癌作用而b没有,则两者互为( )
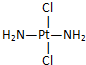 和
和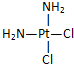 ,a具有抗癌作用而b没有,则两者互为( )
,a具有抗癌作用而b没有,则两者互为( )| A. | 同分异构体 | B. | 同素异形体 | C. | 同系物 | D. | 同种物质 |
20.下列说法中正确的组合是( )
①质子数相同的微粒一定是同种元素
②电子数相同的微粒不一定是同一种元素
③化学键是两个原子之间的相互作用力
④离子键和极性键只存在于化合物中
⑤化学键的断裂和形成是化学反应能量变化的主要原因.
①质子数相同的微粒一定是同种元素
②电子数相同的微粒不一定是同一种元素
③化学键是两个原子之间的相互作用力
④离子键和极性键只存在于化合物中
⑤化学键的断裂和形成是化学反应能量变化的主要原因.
| A. | ①②③ | B. | ①③④ | C. | ②④⑤ | D. | ②③⑤ |
4. 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.I3-离子的中心原子周围σ键电子对对数为2,孤电子对对数为3与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2
(5)已知ClO2-为V形,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
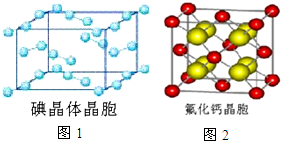
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2
(5)已知ClO2-为V形,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
1.如表实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
2.下列数据记录合理的是( )
| A. | 用托盘天平称取8.75 g食盐 | |
| B. | 用25 mL量筒量取12.36 mL盐酸 | |
| C. | 用广泛pH试纸测得某溶液pH值为3.5 | |
| D. | 用碱式滴定管移取NaOH溶液23.10 mL |
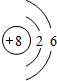 .D在元素周期表中的位置是第3周期ⅢA.
.D在元素周期表中的位置是第3周期ⅢA. 试回答下列问题:
试回答下列问题: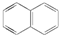 .萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.
.萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.