题目内容
10.铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制铵明矾晶体[NH4Al(SO4)2•12H2O]的工艺流程如图1所示: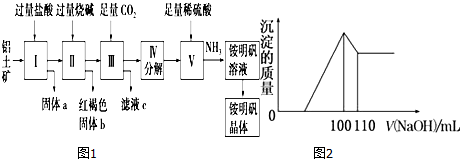
请回答下列问题:
(1)固体a的化学式为SiO2,固体b化学式为Fe(OH)3,Ⅲ中通入足量CO2气体发生反应的离子方程式为AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓.
(2)由Ⅴ制取铵明矾溶液的化学方程式为Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O.
(3)由I→II→III→IV都要用到的分离方法是过滤,由铵明矾溶液中制铵明矾晶体的操作是蒸发浓缩、冷却结晶、过滤洗涤.
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是Fe2O3.
(5)向10gFe2O3、SiO2和Al2O3的混合物中,加入100ml稀硫酸,过滤后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图2所示.则混合物中三氧化二铝的质量分数为51%.
分析 铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体,以此解答该题.
解答 解:铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体.
(1)由以上分析可知a为SiO2,b为Fe(OH)3,Ⅲ中通入足量CO2气体发生反应的离子方程式为AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓,
故答案为:SiO2;Fe(OH)3;AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓;
(2)由图中Ⅴ制取铵明矾溶液的化学方程式为:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O,
故答案为:Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O;
(3)I→II→III→IV都存在固体和液体的分离,应用过滤的方法,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:过滤;蒸发浓缩、冷却结晶、过滤洗涤;
(4)如果先向铝土矿加入过量氢氧化钠,因氧化铁与氢氧化钠不反应,则首先出现的固体a为Fe2O3,故答案为:Fe2O3;
(5)加入盐酸体积100mL~110mL时发生的反应为Al(OH)3+OH-=AlO2-+2H2O,可知n(Al(OH)3)=n(NaOH)=0.01L×10mol/L=0.1mol,则n(Al2O3)=0.05mol,
m(Al2O3)=0.05mol×102g/mol=5.1g,
则混合物中三氧化二铝的质量分数为$\frac{5.1g}{10g}×100%$=51%,
故答案为:51%.
点评 本题考查化学工艺流程、物质的分离提纯、化学计算等,为高考常见题型,需要学生具备综合运用知识分析问题、解决问题能力,难度中等.

| A. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| B. | 1mol/L0.5L的 AlCl3溶液中,阳离子的物质的量大于0.5mol | |
| C. | 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 | |
| D. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中,K+、ClO-、SO42-一定能大量共存 |
| A. |  和 和 | B. | □和△ | ||
| C. | CH3COCH3 和 CH3CHO | D. | CH3Cl 和ClCH2CH2Cl |
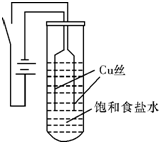
| 物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 (不稳定) | 氯化亚铜 |
| 颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
| A. | 电解过程中氯离子向阳极移动 | B. | 电解开始时阳极Cu 放电生成Cu2+ | ||
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | D. | 随溶液pH升高CuCl逐渐转化为CuOH |
| A. | C2H4 | B. | CH3-CH2-CH2-CH3 | C. | C2H5OH | D. | O2 |
| A. | CH3-CH═CH2与  | B. | 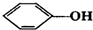 与 与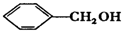 | ||
| C. | HCOOC2H5与CH3COOCH3 | D. | 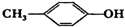 与 与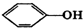 |
| A. | 甲苯与溴水 | B. | 乙酸钠溶液与硫酸 | ||
| C. | 甲苯与KMnO4酸性溶液 | D. | 甲酸溶液与银氨溶液水浴共热 |
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 | 实验结论 氧化性从强到弱的顺序:氯、溴、碘 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管.
(2)②中反应的化学方程式为2NaBr+Cl2═2NaCl+Br2.
③中反应的离子方程式为Cl2+2I-═2Cl-+I2.
(3)CCl4在实验中所起的作用是萃取剂.
(4)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是将溴水滴在KI淀粉试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).
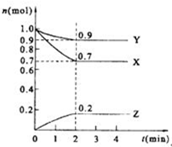 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.