题目内容
7.在天平两边的托盘上各放一只等质量的烧杯,烧杯中各盛放等质量、等浓度的稀硫酸,向两烧杯中分别放入一块铁片和铝片(均与硫酸完全反应),天平仍然平衡.则放入的铁片和铝片的物质的量之比是( )| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 4:9 |
分析 反应前烧杯、硫酸溶液的质量相等,向两烧杯中分别放入一块铁片和铝片(均与硫酸完全反应),天平仍然平衡,说明加入金属后溶液增加的质量相等,据此进行解答.
解答 解:发生反应为:Fe+H2SO4═FeSO4+H2↑、2Al+3H2SO4═Al2(SO4)3+3H2↑,
反应后太平仍平衡,说明反应前后溶液增加的质量相等,
设加入铁片的物质的量为x,铝的物质的量为y,则
Fe+H2SO4═FeSO4+H2↑△m
1mol 54g
x 54xg
2Al+3H2SO4═Al2(SO4)3+3H2↑△m
2mol 48g
y 24yg
则:54x=24y,整理可得x:y=4:9,
故选D.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握差量法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
17.下列实验能达到测量要求的是( )
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
15.在CO2中,Mg燃烧生成MgO和C,下列说法不正确( )
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)<r(Mg) | |
| C. | 元素C 在自然界中既有游离态又有化合态 | |
| D. | 该反应中化学能全部转化为热能 |
2.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点、已知:
①太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(g)+H2O(g)=CO(g)+H2(g)△H2=+13.13kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ•mol-1
下列说法正确的是( )
①太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(g)+H2O(g)=CO(g)+H2(g)△H2=+13.13kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ•mol-1
下列说法正确的是( )
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
19.NA为阿伏加徳罗常数的值,下列叙述正确的是( )
| A. | lmol Cl2与足量的铁充分反应,.转移的电子数为2NA | |
| B. | 标准状况下,11.2L水所含分子数为0.5NA | |
| C. | 常温常压下,22.4L氖气含有NA个氖原子 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业
在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol•L-1•min-1.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2B.v正(H2)=3v正(N2 )
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v正>v逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol•L-1•min-1.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2B.v正(H2)=3v正(N2 )
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v正>v逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
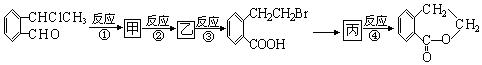
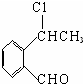 +O2$\stackrel{催化剂}{→}$2
+O2$\stackrel{催化剂}{→}$2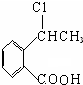 ,氧化反应.
,氧化反应.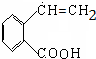 +NaCl+H2O,消去反应.
+NaCl+H2O,消去反应. →丙实际需要两步才能完成,写出第一步反应的化学方程式
→丙实际需要两步才能完成,写出第一步反应的化学方程式 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.
+NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.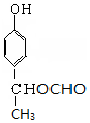 和
和 .
.
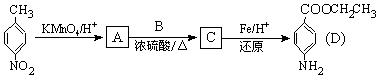
 、BCH3CH2OH、C
、BCH3CH2OH、C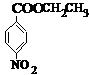 .
.
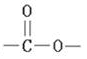
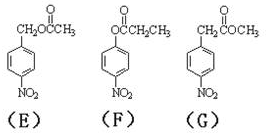
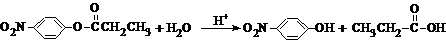 .
.

 的流程图(无机试剂任选).合成路线流程图示如图:
的流程图(无机试剂任选).合成路线流程图示如图: