题目内容
一定温度下,在密闭容器中,将a mol PCl5充入后有如下平衡:PCl5(g)![]() PCl3(g)+Cl2(g)测得此时的压强P1,再向容器中通入a mol PCl5,同温下达到平衡后,测得压强为P2,则下列关系正确的是
PCl3(g)+Cl2(g)测得此时的压强P1,再向容器中通入a mol PCl5,同温下达到平衡后,测得压强为P2,则下列关系正确的是
[ ]
A.2P1=P2
B.2P1>P2
C.2P1<P2
D.无法确定
答案:B
解析:
解析:
|
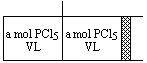
分析: 本题涉及浓度和压强对化学平衡的影响,增大 PCl5的浓度平衡向正反应方向移动,且正反应方向又是气体体积增大的方向,所以压强一定会增大,而增大压强又要使平衡向气体体积减小的方向移动,这样出现矛盾.如果用“等效模型”分析就会使问题简化、明了.现设计图装置,左右气室容积均为 V L,中间有隔板(体积忽略不计,抽去后不漏气),右端装有活塞.现在左右两室分别通入a mol PCl5气体,在相同条件下两室反应均达到平衡后,两室内压强均为P1(同一平衡状态),将隔板抽去后容器内压强仍为P1.若将右端活塞向左缓缓推压至原隔板处,使体积为V L,重新达到平衡后的体系状态与题设情境完全等效(同一平衡状态).
同理,如在相同条件下将 a mol PCl5通入V L密闭容器中使之达到平衡后再压缩至如果不考虑平衡移动,当压缩至原来体积的一半时,压强为原来的 2倍,即2P1,但平衡向减小气体体积的方向移动,会使压强减小,故P1<P2<2P1,正确选项为B.答: B. |

练习册系列答案
相关题目