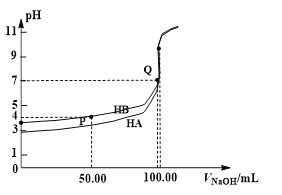
题目内容
【题目】N2H4是一种高效清洁的火箭燃料。8gN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=+267kJ·mol-1
N2(g)+H2O(g) ΔH=+267kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=+534kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5kJ·mol-1
【答案】B
【解析】
8gN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,即0.25mol释放133.5kJ的热量,则1mol时的焓变ΔH=-534kJ/mol,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1,答案为B。

【题目】甲醇(结构式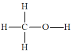 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
(1)已知反应中的相关化学键键能数据如下:
化学键 | O-H | C-O | C=O |
E/(kJ | 465 | 343 | 750 |
甲醇中C-H键比氢气中H-H键____(填“强”或“弱”)。相同条件下该反应的正反应活化能Ea(正)=210 kJ·mol-1,则逆反应活化能Ea(逆)=______kJ·mol-1。
(2)在1 L恒容密闭容器中充入CO2和H2,所得实验数据如下表
实验编号 | 温度/。C | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO2) | n(H2) | n(CH3OH) | ||
① | 150 | 0.23 | 0.19 | 0.03 |
② | 200 | 0.10 | 0.26 | 0.02 |
③ | 200 | 0.17 | a | 0.01 |
实验①平衡常数K=______,若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10 mol,这时反应向________移动(填“正反应方向”、“逆反应方向”或“不”),判断理由是______。
实验②达到平衡时H2转化率为____。
实验③a=_________。
(3)甲醇、空气和稀硫酸可以形成燃料电池,其正极电极反应式为________。