题目内容
【题目】某非金属单质A经下图所示的过程转化为含氧酸D,
![]()
已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①氯水和B皆可作漂白剂。若同时使用于漂白一种物质时,其漂白效果是________(填“增强”“减弱”“不变” ),用化学方程式解释上述原因 ;
②D的浓溶液与铜发生反应的化学方程式: 。
(2)若A在常温下为气体,C是红棕色气体。
①A转化为B的化学方程式是:______________________________________,
② D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式: 。
【答案】(1)①减弱 SO2+Cl2+2H2O=2HCl+H2SO4 ②Cu+2H2SO4 (浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)①N2+O2![]() 2NO ② 3Cu + 8 H++2NO3-=3Cu2++ 2 NO↑+ 4 H2O
2NO ② 3Cu + 8 H++2NO3-=3Cu2++ 2 NO↑+ 4 H2O
【解析】
试题分析:(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体,说明A是S,B是二氧化硫,C是三氧化硫,D是硫酸;
①氯水和B皆可作漂白剂,若同时使用于漂白一种物质时,会发生反应SO2+Cl2+2H2O=2HCl+H2SO4,其漂白效果将减弱;
②D的浓溶液与铜发生反应的化学方程式为Cu+2H2SO4 (浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)若A在常温下为气体,C是红棕色气体,则A是氮气,B是一氧化氮,C是二氧化氮,D是硝酸;
①A转化为B的化学方程式是:N2+O2![]() 2NO;
2NO;
② D的稀溶液在常温下与铜反应并生成B气体,离子方程为3Cu + 8 H++2NO3-=3Cu2++ 2 NO↑+ 4 H2O。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | |||
3 | ⑦ | ⑧ | ⑨ | |||||
4 | ⑩ |
(1)在这些元素中,化学性质最不活泼的是 ,元素原子半径最小的是 ,被称为“国防金属”的是 ,可作为半导体材料的是 ,单质氧化性最强的元素是 。
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是 。
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是 。酸性最强的化合物的化学式是 。
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式 。
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________________________________。
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
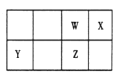
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
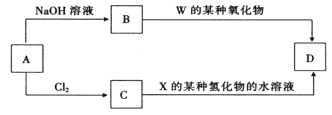
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。

