题目内容
19.下列反应的离子方程式正确的是( )| A. | Fe(OH)2溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 等体积、等物质的量浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO${\;}_{3}^{-}$+2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 淀粉碘化钾溶液在空气变蓝:4I-+O2+2H2O═2I2+4OH- |
分析 A.稀硝酸能够将亚铁离子氧化成铁离子;
B.碳酸氢钙与氢氧化钠的物质的量相等,反应生成碳酸钙沉淀、碳酸氢钠和水;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.碘离子在空气中易被空气中氧气氧化成碘单质.
解答 解:A.向氢氧化亚铁溶液中加入足量的稀硝酸,稀硝酸具有强氧化性,能够氧化亚铁离子,正确的离子方程式为:3Fe(OH)2++10H+=3Fe3++8H2O+NO↑,故A错误;
B.等体积、等物质的量浓度的Ca(HCO3)2溶液和NaOH溶液混合,碳酸氢钙与氢氧化钠的物质的量相等,氢氧化钠不足,反应生成碳酸钙沉淀、碳酸氢钠和水,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故B错误;
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液,反应生成铁离子和水,正确的离子方程式为:2Fe2++2H++H2O2═2Fe3++2H2O,故C错误;
D.淀粉碘化钾溶液在空气中被氧化成碘单质,碘单质遇到淀粉变蓝,反应的离子方程式为:4I-+O2+2H2O═2I2+4OH-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
9.下列各组物质所含化学键类型完全相同的是( )
| A. | HCl和NH4Cl | B. | CaH2和Na2O2 | C. | NaOH和MgCl2 | D. | H2O2和C2H6 |
4.在下列变化中,一定要加入合适的氧化剂才能实现的是( )
| A. | Na2O2→O2 | B. | Cl2→Cl- | C. | Fe(OH)2→Fe(OH)3 | D. | NO2→HNO3 |
1.下列说法正确的是( )
| A. | 分子组成上相差一个或若干个CH2原子团的有机物一定是同系物 | |
| B. | 具有相同的通式且相差一个或若干个CH2原子团的有机物一定是同系物 | |
| C. | 互为同系物的有机物分子结构必然相似 | |
| D. | 互为同系物的有机物通式不一定相同 |
18.NaCl是一种化工原料,可以制备一系列物质(如图).下列说法正确的是( )


| A. | 上述转化关系图只涉及到氯碱工业、工业制漂白粉及工业制纯碱三个化工原理 | |
| B. | 上述转化关系图涉及的物质中除单质外的所有物质均为电解质 | |
| C. | 工业制纯碱的第一步应在饱和食盐水中先通氨气并达饱和后再通过量CO2 | |
| D. | 将氯气在氢气中点燃可看到产生苍白色火焰并伴有白雾 |
19.欲将蛋白质从水中析出而又不改变它的性质,应加入( )
| A. | 甲醛溶液 | B. | 饱和Na2SO4溶液 | C. | 浓硝酸 | D. | 稀CuSO4溶液 |
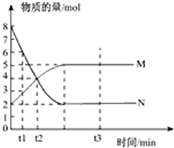 一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为1L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: