题目内容
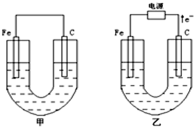
 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
碳
碳
棒,乙池中的铁
铁
棒.②乙池中阳极的电极反应式是
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
②甲池中碳极上电极反应式是
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
,乙池碳极上电极反应属于氧化反应
氧化反应
(填“氧化反应”或“还原反应”).③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去.这是因为过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
5Cl2+I2+6H2O=2HIO3+10HCl
5Cl2+I2+6H2O=2HIO3+10HCl
.④若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,测溶液混匀后的pH=
13
13
.分析:甲装置是原电池,较活泼的金属铁作负极,碳作正极,乙有外接电源属于电解池,根据电子的流向知,碳是阳极,铁是阴极,阳极上失电子发生氧化反应;
(1)若两池中均为CuSO4溶液,反应一段时间后,甲池中,正极上得电子发生还原反应,负极上失电子发生氧化反应,乙池中阴极上得电子发生还原反应,阳极上失电子发生氧化反应;
(2)若两池中均为饱和NaCl溶液,
①电解氯化钠溶液时,阳极上氯离子放电,阴极上水得电子生成氢气和氢氧根离子;
②甲池发生吸氧腐蚀,乙池中碳棒上失电子发生氧化反应;
③根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式;
④根据氢氧化钠和转移电子之间的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH.
(1)若两池中均为CuSO4溶液,反应一段时间后,甲池中,正极上得电子发生还原反应,负极上失电子发生氧化反应,乙池中阴极上得电子发生还原反应,阳极上失电子发生氧化反应;
(2)若两池中均为饱和NaCl溶液,
①电解氯化钠溶液时,阳极上氯离子放电,阴极上水得电子生成氢气和氢氧根离子;
②甲池发生吸氧腐蚀,乙池中碳棒上失电子发生氧化反应;
③根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式;
④根据氢氧化钠和转移电子之间的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH.
解答:解:甲装置是原电池,较活泼的金属铁作负极,碳作正极,乙有外接电源属于电解池,根据电子的流向知,碳是阳极,铁是阴极,阳极上失电子发生氧化反应;
(1)若两池中均为CuSO4溶液,反应一段时间后,①甲池中,正极上铜离子得电子而析出铜,乙池中,阴极铁棒上铜离子得电子而析出铜;
②乙池中阳极上,氢氧根离子失电子生成氧气和水,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:①碳、铁,②4OH--4e-=2H2O+O2↑,
(2)若两池中均为饱和NaCl溶液,
①电解氯化钠溶液时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气 和氢氧根离子,所以电池反应式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②甲池中碳极上氧气得电子和水反应生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,
乙池碳极上氯离子失电子发生氧化反应,
故答案为:2H2O+O2+4e-=4OH-,氧化反应;
③过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
④设生成氢氧化钠的浓度是Cmol/L,
2Cl-+2H2O
Cl2↑+H2↑+2OH-转移电子
2mol 2mol
0.2Cmol 0.02mol
C=
=0.1,即氢氧化钠的物质的量浓度是0.1mol/L,则溶液的pH=13,
答:氢氧化钠溶液的pH=13.
(1)若两池中均为CuSO4溶液,反应一段时间后,①甲池中,正极上铜离子得电子而析出铜,乙池中,阴极铁棒上铜离子得电子而析出铜;
②乙池中阳极上,氢氧根离子失电子生成氧气和水,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:①碳、铁,②4OH--4e-=2H2O+O2↑,
(2)若两池中均为饱和NaCl溶液,
①电解氯化钠溶液时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气 和氢氧根离子,所以电池反应式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
②甲池中碳极上氧气得电子和水反应生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,
乙池碳极上氯离子失电子发生氧化反应,
故答案为:2H2O+O2+4e-=4OH-,氧化反应;
③过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
④设生成氢氧化钠的浓度是Cmol/L,
2Cl-+2H2O
| ||
2mol 2mol
0.2Cmol 0.02mol
C=
| 2mol×0.02mol |
| 2mol×0.2mol |
答:氢氧化钠溶液的pH=13.
点评:本题考查了原电池和电解池原理,难度不大,注意电解池中,如果活泼金属作阳极,则阳极上金属失电子发生氧化反应,而不是溶液中阴离子失电子发生氧化反应,为易错点.

练习册系列答案
相关题目
 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: 如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题: 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
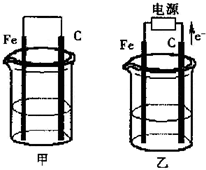 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: