题目内容
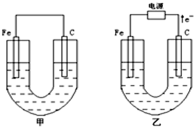 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后
①有红色物质析出的是甲池中的
碳
碳
棒,乙池中的铁
铁
棒.②乙池中阳极的电极反应式是
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
②甲池中碳极上电极反应式是
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,乙池碳极上电极反应属于氧化反应
氧化反应
(填氧化反应、还原反应).③若乙池转移0.02mole-后停止实验,溶液体积是200mL,则溶液混匀后的pH=
13
13
.分析:(1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
③乙池转移0.02mole-,由2e-~2NaOH计算.
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
③乙池转移0.02mole-,由2e-~2NaOH计算.
解答:解:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②甲中碳为正极,氢氧根离子失去电子,电极反应为4OH--4e-=O2↑+2H2O,乙中碳为阳极,发生氧化反应;
故答案为:4OH--4e-=O2↑+2H2O;氧化反应;
③乙池转移0.02mole-,由2e-~2NaOH可知,n(NaOH)=0.02mol,c(NaOH)=
=0.1mol/L,所以pH=13,故答案为:13.
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O
| ||
| ||
②甲中碳为正极,氢氧根离子失去电子,电极反应为4OH--4e-=O2↑+2H2O,乙中碳为阳极,发生氧化反应;
故答案为:4OH--4e-=O2↑+2H2O;氧化反应;
③乙池转移0.02mole-,由2e-~2NaOH可知,n(NaOH)=0.02mol,c(NaOH)=
| 0.02mol |
| 0.2L |
点评:本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
 如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题: 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
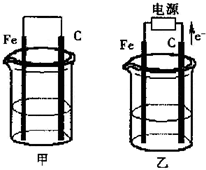 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: