题目内容
【题目】为研究乙醇的结构及化学性质,进行下列实验。试回答下列问题:
Ⅰ.用如图所示装置来推测乙醇的结构式。

(1)实验中钠需要粉碎成很小的颗粒,其原因是___。
(2)两次实验平均均用乙醇1.15g,收集到气体的体积平均为0.28L(标准状况下)。上实验数据可以推测乙醇分子的结构,依据是___。
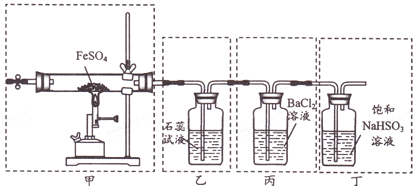
Ⅱ.利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(夹持装置已略去)

(3)装置A圆底瓶内的固体物质是___,C中热水的作用是___。
(4)实验过程中D装置可以观察到的实验现象为___,写出D处发生反应的化学方程式:___。
(5)检验E中的生成物的方法为___。
【答案】增大接触面积以提高反应速率 通过计算可知,2mol乙醇与足量钠反应生成1molH2,说明1mol乙醇分子中存在1mol活泼氢原子 MnO2 使液态乙醇转化为乙醇蒸气 铜粉一会儿变黑,一会变红 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 在洁净的试管中加入新制的氢氧化铜悬浊液,再加入少量E中的溶液,加热煮沸,试管中出现砖红色沉淀,说明生成了乙醛
2CH3CHO+2H2O 在洁净的试管中加入新制的氢氧化铜悬浊液,再加入少量E中的溶液,加热煮沸,试管中出现砖红色沉淀,说明生成了乙醛
【解析】
(1)钠与乙醇的反应比较缓慢,实验中将钠粉碎成很小的颗粒,可以增大接触面积以提高反应速率。
(2)钠与乙醇反应放出0.28L氢气(标准状况下),则氢气的物质的量为![]() ,1.15g乙醇的物质的量为
,1.15g乙醇的物质的量为![]() ,则
,则![]() ,说明1mol乙醇分子中存在1mo活泼氢原子。
,说明1mol乙醇分子中存在1mo活泼氢原子。
(3)装置A是生成氧气的装置,![]() 在二氧化锰催化作用下分解放出氧气,因此装置A圆底烧瓶内的固体物质二氧化锰;乙醇易挥发,C中热水可以使液态乙醇转化为乙醇蒸气。
在二氧化锰催化作用下分解放出氧气,因此装置A圆底烧瓶内的固体物质二氧化锰;乙醇易挥发,C中热水可以使液态乙醇转化为乙醇蒸气。
(4)铜催化氧化乙醇,实际上包括两个过程:一个是铜与氧气反应生成氧化铜,一个是氧化铜氧化乙醇生成铜,因此实验过程中D装置可以看到铜粉一会儿变黑,一会变红。D处发生反应的总方程式为![]()
![]() 。
。
(5)E中为含乙醛的水溶液,因此检验E中的生成物的方法为在洁净的试管中加入新制的氢氧化铜悬浊液,再加入少量E中的溶液,加热煮沸,若试管中出现砖红色沉淀,说明生成了乙醛。

【题目】在不同条件下进行化学反应![]() ,B、D起始浓度均为0,反应物A的浓度
,B、D起始浓度均为0,反应物A的浓度![]() 随反应时间的变化情况如下表:下列说法不正确的是( )
随反应时间的变化情况如下表:下列说法不正确的是( )
序号 | 时间 温度 | 0 | 20 | 40 | 50 |
① | 800 |
|
|
|
|
② | 800 | x |
|
|
|
③ | 800 | y |
|
|
|
④ | 820 |
|
|
|
|
A.①中B在![]() min平均反应速率为
min平均反应速率为![]()
![]()
B.②中![]() ,可能使用了催化剂
,可能使用了催化剂
C.③中![]()
![]()
D.比较①④可知,该反应为吸热反应
【题目】用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是

选项 | a | b | c | 现象 | 结论 |
A | 饱和食盐水 | 碳化钙 | 酸性 | c中溶液紫色褪去 | 乙炔具有还原性 |
B | 浓盐酸 |
| NaBr溶液 | c中溶液由无色变橙色 |
|
C | 稀盐酸 | 大理石 |
| c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
D | 硫酸 |
| 品红溶液 | c中溶液红色褪去 |
|
A.AB.BC.CD.D