题目内容
【题目】在不同条件下进行化学反应![]() ,B、D起始浓度均为0,反应物A的浓度
,B、D起始浓度均为0,反应物A的浓度![]() 随反应时间的变化情况如下表:下列说法不正确的是( )
随反应时间的变化情况如下表:下列说法不正确的是( )
序号 | 时间 温度 | 0 | 20 | 40 | 50 |
① | 800 |
|
|
|
|
② | 800 | x |
|
|
|
③ | 800 | y |
|
|
|
④ | 820 |
|
|
|
|
A.①中B在![]() min平均反应速率为
min平均反应速率为![]()
![]()
B.②中![]() ,可能使用了催化剂
,可能使用了催化剂
C.③中![]()
![]()
D.比较①④可知,该反应为吸热反应
【答案】C
【解析】
A.![]() 中A在
中A在![]() min浓度变化为
min浓度变化为![]() ,化学反应
,化学反应![]() ,B在
,B在![]() min浓度变化为
min浓度变化为![]() ,B在
,B在![]() min平均反应速率为
min平均反应速率为
![]() ,故A正确;
,故A正确;
B.![]() 、
、![]() 起始量相同,平衡浓度相同,但
起始量相同,平衡浓度相同,但![]() 达到平衡所需要的时间短,反应速率快,说明加入了催化剂,加快反应速率,平衡常数不变,
达到平衡所需要的时间短,反应速率快,说明加入了催化剂,加快反应速率,平衡常数不变, ,故B正确;
,故B正确;
C. 列出三段式:

![]() 和
和![]() 的温度相同,平衡常数相同,
的温度相同,平衡常数相同,![]() ,解得
,解得![]()
![]() ,故C错误;
,故C错误;
D.比较![]() 和
和![]() 可知平衡时
可知平衡时![]() 反应物A的浓度小,由
反应物A的浓度小,由![]() 到
到![]() 升高温度,平衡右移,加热平衡向吸热反应方向移动,则正反应为吸热反应,故D正确;
升高温度,平衡右移,加热平衡向吸热反应方向移动,则正反应为吸热反应,故D正确;
故选C。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
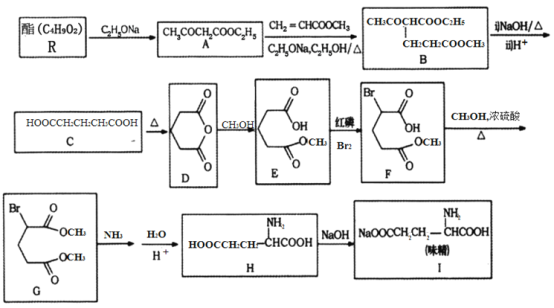
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
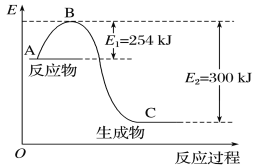
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:___kJ·mol-1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+![]() O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
则△H1____△H2
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3______△H4