题目内容
(1)有两瓶pH都等于2的无色溶液:一瓶是强酸,一瓶是弱酸.为了对它们作出鉴别,某学生只用蒸馏水和pH试纸,便得出了结论,试简述其方法和结论: .
(2)试设计一个简单的实验证明,在醋酸溶液中存在着CH3COOH?CH3COO-+H+的电离平衡.(要求写出简要操作、现象及实验能说明的问题) .
(2)试设计一个简单的实验证明,在醋酸溶液中存在着CH3COOH?CH3COO-+H+的电离平衡.(要求写出简要操作、现象及实验能说明的问题)
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据强酸和弱酸稀释相等的倍数后,pH变化情况不一样强酸完全电离,弱酸存在电离平衡,据此回答;
(2)根据醋酸的电离平衡移动的影响因素来回答判断即可,若加入的物质影响醋酸离子的浓度,同时还会引起氢离子的浓度变化,则说明存在电离平衡.
(2)根据醋酸的电离平衡移动的影响因素来回答判断即可,若加入的物质影响醋酸离子的浓度,同时还会引起氢离子的浓度变化,则说明存在电离平衡.
解答:
解:(1)强酸和弱酸稀释相等的倍数后,pH变化情况不一样,可以等倍数(如1000倍)地稀释两种溶液,稀释过程中pH变化大的是强酸,变化小的是弱酸,故答案为:等倍数(如1000倍)地稀释两种溶液,稀释过程中pH变化大的是强酸,变化小的是弱酸;
(2)在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在CH3COOH?CH3COO-+H+的电离平衡.(注意:用CH3COONH4晶体而不是用CH3COONa晶体,是因为CH3COONH4在溶液中呈中性,故选择之).
故答案为:在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在CH3COOH?CH3COO-+H+的电离平衡.
(2)在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在CH3COOH?CH3COO-+H+的电离平衡.(注意:用CH3COONH4晶体而不是用CH3COONa晶体,是因为CH3COONH4在溶液中呈中性,故选择之).
故答案为:在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在CH3COOH?CH3COO-+H+的电离平衡.
点评:本题考查了弱电解质的电离,根据酸与酸碱指示剂的关系结合影响弱电解质电离的因素来分析解答,知道哪些因素促进醋酸电离、哪些因素抑制醋酸电离,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应的现象描述与离子方程式都正确的是( )
| A、金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-═MgCl2+H2↑ |
| B、氯化钡溶液与稀硫酸反应:有白色沉淀生成Ba2++SO42-═BaSO4↓ |
| C、碳酸钠溶液与盐酸反应:有气泡逸出Na2CO3+2H+═2Na++CO2↑+H2O |
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
近年来,建筑装潢装饰材料进入家庭,调进发现,经过装修的居室以中由装潢装饰材料缓慢释放出来的化学污染物浓度过高,影响健康.这些污染物中最常见的是( )
| A、CO |
| B、SO2 |
| C、甲醛、甲苯等有机物蒸气 |
| D、臭氧 |
中学化学实验中应用最广泛的仪器之一是滴瓶.滴瓶用于盛放各种溶液,关于滴瓶中滴管的使用,叙述不正确的是( )
| A、试管中滴加溶液时,滴管尖嘴要伸入试管口内,以防溶液滴到试管外 |
| B、不能将滴管水平拿持 |
| C、加完药品后可将滴管放回原瓶 |
| D、滴管除了原滴瓶外,不能放别的地方 |
把一定量的有机物溶于NaOH溶液中,滴入酚酞试液呈红色,煮沸5分钟后,溶液颜色变浅,再加入盐酸,显酸性析出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色,则有机物可能是下列物质中的( )
A、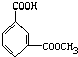 |
B、 |
C、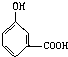 |
D、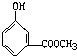 |
下列实验能达到预期目的是( )
| A、加NaOH溶液后进行分液来分离乙醇和苯酚 |
| B、测定Na2CO3、Na2SO4两溶液的pH,比较碳、硫的非金属性强弱 |
| C、在MgCl2、AlCl3溶液中分别通入NH3,比较镁、铝的金属性强弱 |
| D、称量2.5gCuSO4?5H2O晶体溶于100mL水配制0.10mol?L-1的硫酸铜溶液 |
有关Na2CO3 和NaHCO3的下列叙述中错误的是( )
| A、相同质量的NaHCO3和Na2CO3 与足量盐酸反应,Na2CO3 产生的CO2少 |
| B、将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3 溶液中产生白色沉淀 |
| C、向Na2CO3 饱和溶液中通入足量CO2气体会出现浑浊 |
| D、Na2CO3 中含少量NaHCO3,可用加热的方法除去 |
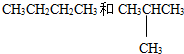 D.甲烷和庚烷E.液氯与氯气
D.甲烷和庚烷E.液氯与氯气 和
和