题目内容
下列说法正确的是( )
| A、在化学反应中某元素化合价升高,该元素一定被还原了 |
| B、金属单质在氧化还原反应中只能作还原剂 |
| C、在氧化还原反应中,非金属单质一定是氧化剂 |
| D、有气体生成的化学反应一定是氧化还原反应 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.元素化合价升高,失去电子,被氧化;
B.金属单质在反应中只能失去电子;
C.非金属单质既能失去电子,也能得到电子;
D.有气体生成的化学反应,不一定有元素的化合价变化.
B.金属单质在反应中只能失去电子;
C.非金属单质既能失去电子,也能得到电子;
D.有气体生成的化学反应,不一定有元素的化合价变化.
解答:
解:A.元素化合价升高,失去电子,被氧化,发生氧化反应,则在化学反应中某元素化合价升高,该元素一定被氧化,故A错误;
B.金属单质在反应中只能失去电子,所以金属单质在氧化还原反应中只能作还原剂,故B正确;
C.非金属单质既能失去电子,也能得到电子,如Cl2+H2O═HCl+HClO,非金属单质可以是氧化剂,也可为还原剂,故C错误;
D.有气体生成的化学反应,不一定有元素的化合价变化,如二氧化碳与水反应生成碳酸为非氧化还原反应,故D错误;
故选B.
B.金属单质在反应中只能失去电子,所以金属单质在氧化还原反应中只能作还原剂,故B正确;
C.非金属单质既能失去电子,也能得到电子,如Cl2+H2O═HCl+HClO,非金属单质可以是氧化剂,也可为还原剂,故C错误;
D.有气体生成的化学反应,不一定有元素的化合价变化,如二氧化碳与水反应生成碳酸为非氧化还原反应,故D错误;
故选B.
点评:本题考查氧化还原反应,为高频考点,侧重氧化还原反应基本概念的考查,注意从元素的化合价角度和常见的反应实例分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列对元素周期表说法不正确的是( )
| A、在金属和非金属的分界线附近可以找到半导体材料 |
| B、第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性 |
| C、如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置 |
| D、目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质 |
下列关于铝的叙述中正确的是( )
| A、铝合金是一种混合物,它比纯铝的熔点高 |
| B、由于铝的导电性比铜、银都强,所以常用其制造电线、电缆 |
| C、由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属 |
| D、常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸 |
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、纯碱溶液:NH4+、K+、NO3-、NH3?H2O |
| B、空气:C2H2、CO2、SO2、NO |
| C、氢氧化铁胶体:H+、K+、S2-、Br- |
| D、高锰酸钾溶液:H+、Na+、SO42-、H2O2 |
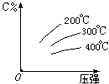 可逆反应mA (g)+nB(s)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA (g)+nB(s)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A、达平衡后,加入催化剂,加快反应速率,使C%增大 |
| B、达平衡后,增加B的量有利于平衡向正反应方向移动 |
| C、化学方程式中m+n<e+f |
| D、该可逆反应的正反应的△H<0 |
电化学降解法治理水中硝酸盐的污染原理如图所示.下列说法正确的是( )


| A、B为电源正极 |
| B、电解过程中H+向阳极移动 |
| C、阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH- |
| D、理论上电解过程中阴、阳两极产生的气体在同温同压下体积比为2:5 |
给5mL某液体加热,操作中所用仪器是:( )
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网.
①试管 ②烧杯 ③酒精灯 ④试管夹 ⑤石棉网.
| A、①②③ | B、①③④ |
| C、①③⑤ | D、②③④ |
下列离子方程式中正确的是( )
| A、澄清石灰水与稀盐酸反应Ca(OH) 2+2H+=Ca2++2H2O |
| B、氢氧化钡与硫酸铜溶液混合:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu (OH) 2↓ |
| C、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D、氯化铁溶液与氨水反应Fe3++3OH-=Fe (OH)3↓ |
浓H2SO4能干燥氯气,是利用了浓H2SO4的( )
| A、强酸性 | B、吸水性 |
| C、脱水性 | D、强氧化性 |