题目内容
某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2  2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求
2SO3反应.5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%.求
(1)以SO3的浓度变化表示该反应的化学反应速率;
(2)该反应中SO2的平衡转化率.
(1)以SO3的浓度变化表示该反应的化学反应速率;
(2)该反应中SO2的平衡转化率.
分析:设平衡时转化的氧气的物质的量为x,根据同温同体积时气体的压强之比等于物质的量之比,利用三段式法计算反应的氧气的物质的量,进而计算出反应的三氧化硫的物质的量,则可求出反应速率;根据反应方程式计算出反应的二氧化硫的物质的量,进而求出反应中SO2的平衡转化率.
解答:解:设平衡时转化的氧气的物质的量为x,利用三段式法计算.
2SO2+O2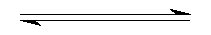 2SO3
2SO3
初始 0.3mol 0.2mol 0
变化 2x x 2x
平衡 0.3mol-2x 0.2mol-x 2x
同温同体积下
=
=
=90%
解得x=0.05mol,
(1)平衡时n(SO3)=2×0.05mol=0.1mol,则v(SO3)=
=0.01mol?L-1?min-1
答:以SO3的浓度变化表示该反应的化学反应速率为0.01mol/(L?min).
(2)平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为
×100%=33.3%
答:该反应中SO2的平衡转化率为33.3%.
2SO2+O2
初始 0.3mol 0.2mol 0
变化 2x x 2x
平衡 0.3mol-2x 0.2mol-x 2x
同温同体积下
| P1 |
| P2 |
| n1 |
| n2 |
| 0.3mol-2x+0.2mol-x+2x |
| 0.3mol+0.2mol |
解得x=0.05mol,
(1)平衡时n(SO3)=2×0.05mol=0.1mol,则v(SO3)=
| 2×0.05mol |
| 2L×5min |
答:以SO3的浓度变化表示该反应的化学反应速率为0.01mol/(L?min).
(2)平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为
| 2×0.05mol |
| 0.03mol |
答:该反应中SO2的平衡转化率为33.3%.
点评:本题考查化学平衡的有关计算,题目难度不大,本题注意根据阿伏伽德罗定律,利用三段式法计算.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
 2C(g)+2D(g),
2C(g)+2D(g), 2 SO3反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%。求
2 SO3反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%。求