题目内容
在碳酸钠的饱和溶液中,C(Na+)和C(CO32-)的比值( )
| A、等于1 | B、等于2 |
| C、大于2 | D、1-2之间 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,钠离子不水解,据此分析解答.
解答:
解:碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性CO32-+H2O?HCO3-+OH-,钠离子不水解,所以溶液中C(Na+)和C(CO32-)的比值大于2,故选C.
点评:本题考查了盐类水解,根据水解的离子、不水解的离子来确定C(Na+)和C(CO32-)的比值,知道常见水解的离子,题目难度不大.

练习册系列答案
相关题目
下列能用勒沙特列原理解释的是( )
| A、反应3NH4SCN+FeCl3?Fe(SCN)3+3NH4Cl平衡后,加入NH4Cl固体溶液颜色变深 |
| B、红棕色NO2加压后颜色先变深后变浅 |
| C、SO2氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混和气加压后颜色变深 |
反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行.下列条件的改变对其反应速率几乎无影响的是( )
| A、压缩容器体积,增大体系压强 |
| B、加入适当的催化剂 |
| C、保持压强不变,充入惰性气体使容器容积增大 |
| D、保持容器容积不变,充入惰性气体使体系压强增大 |
把铜粉和铁粉的混合物放入一定量的稀硝酸中,微热,反应完毕发现铜有剩余,则溶液中含有的阳离子是( )
| A、Cu2+、Fe2+ |
| B、Cu2+、Fe2+、Fe3+ |
| C、Cu2+、Fe3+ |
| D、Fe3+ |
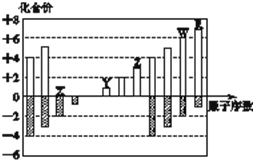 如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:R>W |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、Y和Z两者最高价氧化物对应的水化物不能相互反应 |
X、Y、Z、W、U是分别位于短周期的元素,原子序数依次递增.X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.Y元素的单质在X的某种氧化物中可燃.下列说法正确的是( )
| A、W的最高价氧化物能与水反应生成相应的酸 |
| B、M原子核内比X多一个质子,M的气态氢化物的水溶液能溶解Z的氧化物 |
| C、U单质可以溶解于X和U形成的化合物中 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |