题目内容
如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。

若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
(1)CH4-8e-+10OH-=CO32—+7H2O
(2)2Cl--2e-=Cl2↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液(或饱和食盐水) 铁
【解析】(1)甲烷燃料电池负极上发生氧化反应,即甲烷在负极上被氧化。在KOH溶液中甲烷被氧化后生成碳酸钾,负极反应式为CH4-8e-+10OH-=CO32—+7H2O。(2)电池的负极与电解池的阴极相接,铁极为阴极,则C极为阳极,在C极上发生氧化反应,电极反应式为2Cl--2e-=Cl2↑。(3)n(O2)=2.24/22.4=0.1 mol,甲池中正极反应式为O2+4e-+2H2O=4OH-,由电子守恒知,经过甲、乙、丙装置的电子的物质的量为0.4 mol。乙池中的铁极与甲池的负极相连,铁极为阴极,发生还原反应,电极反应式为2H2O+2e-=2OH-+H2↑,n(H2)=0.4/2=0.2 mol,V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。丙池中精铜为阴极,发生还原反应,电极反应式为Cu2++2e-=Cu,n(Cu)=0.4/2=0.2 mol,m(Cu)=0.2 mol×64 g·mol-1=12.8 g。(4)漂白液的有效成分是次氯酸盐,制备原理是2Cl-+2H2O 2OH-+Cl2↑+H2↑,Cl2+2OH-=Cl-+ClO-+H2O,气体与液体反应,最好采用逆向接触,即气体在下端产生,碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,上端为阴极,阴极与电源负极相连,故a极为负极。生活中常见且廉价的氯化物是氯化钠,故电解质溶液最好用饱和氯化钠溶液。若制备氢氧化亚铁,用硫酸钠溶液作电解质溶液,选用铁作阳极。
2OH-+Cl2↑+H2↑,Cl2+2OH-=Cl-+ClO-+H2O,气体与液体反应,最好采用逆向接触,即气体在下端产生,碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,上端为阴极,阴极与电源负极相连,故a极为负极。生活中常见且廉价的氯化物是氯化钠,故电解质溶液最好用饱和氯化钠溶液。若制备氢氧化亚铁,用硫酸钠溶液作电解质溶液,选用铁作阳极。

下列有关分散系的说法正确的是( )。
A.一种分散系中可以有一种分散质,也可以有多种分散质
B.浊液的分散质都能通过过滤从分散剂中分离出来
C.分散剂一定是液体
D.同一种溶质的饱和溶液要比不饱和溶液的浓度大
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。

(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
编号 | 反应物 | 反应前pH | 反应后pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
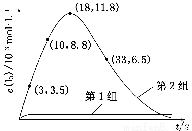
图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。








