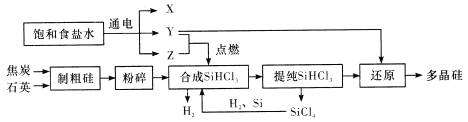
题目内容
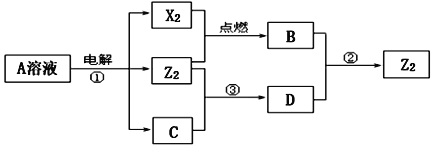
【题目】碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为3∶1)直接作燃料,其工作原理如图所示,并以此电源用于工业生产。
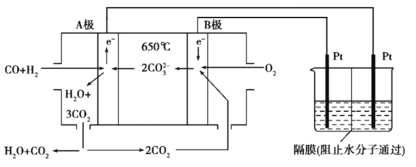
(1)H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1,1g液态水变为水蒸气时吸热2.44kJ,则电池总反应3CO(g)+H2(g)+2O2(g)=3CO2(g)+H2O(g)的ΔH=___________kJ·mol-1,B电极上发生反应的电极反应式为___________。
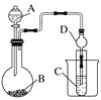
(2)若以此电源生产新型硝化剂N2O5,装置如上图所示。已知两室加入的试剂分别是a.硝酸溶液b.N2O4+无水硝酸,则左室加入的试剂应为___________(填“a”或“b”),其电极反应式为___________。
(3)若以此电源用惰性电极电解足量的硝酸银溶液,阴极产物的质量为5.4g,则阳极产生的气体在标准状况下的体积为___________L。电解后溶液体积为500mL,溶液的pH约为___________。
【答案】-1090.88 ![]() b
b ![]() 0.28 1
0.28 1
【解析】
在计算反应的焓变时,一定要注意物质的聚集状态;书写电极反应式时首先要明确电极的极性,即确定是得电子还是失电子,再结合具体环境分析产物的形式,最终将电极反应式书写出来。
(1)由题可知,H2燃烧热的热化学方程式为:①![]()
![]() ;CO燃烧热的热化学方程式为:②
;CO燃烧热的热化学方程式为:②![]()
![]() ;此外还有:③
;此外还有:③![]()
![]() ;通过分析可知电池总反应的
;通过分析可知电池总反应的![]() ;由示意图可知B电极为正极,其电极反应式为:
;由示意图可知B电极为正极,其电极反应式为:![]() ;
;
(2)由示意图可知左槽中的为阳极,发生氧化反应,所以左槽中应当加入b;左槽中电极反应式为:![]() ;
;
(3)惰性电极电解硝酸银时,阴极发生银离子的还原反应生成银单质,因此生成5.4g产物时,外电路电子转移0.05mol,阳极的电极反应式为:![]() ,因此产生的标况下的O2的体积为:
,因此产生的标况下的O2的体积为:![]() ;此过程生成了0.05mol的H+,体积为500mL,所以c(H+)=0.1mol/L,pH约为1。
;此过程生成了0.05mol的H+,体积为500mL,所以c(H+)=0.1mol/L,pH约为1。