题目内容
10.(物质与结构)元素周期表中,金属和非金属分界线附近的元素以及过渡元素性质特殊,其单质和化合物应用广泛,成为科学研究的热点.(1)锗(Ge)可以作半导体材料,写出基态锗原子的电子排布式:1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
(2)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得
①Ti的基态原子有22种运动状态不同的电子(2分)
②材料LiBH4中Li、B、H元素的电负性由大到小的顺序为H>B>Li
③LiBH4由Li+和BH4-构成,BH4-的空间构型是正四面体,中心原子的杂化方式:
SP3杂化,LiBH4中不存在的化学键有C(填字母)
A.离子键 B.共价键 C.金属键 D.配位键
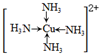
(3)铜的氯化物与氨水反应可形成配合物[Cu(NH3)4]Cl2该配合物的配位数是:4,1mol该配合物中含有δ健的数目为16NA,画出配离子[Cu(NH3)4]2+的结构简式
(4)第三周期元素的第一电离能随着原子序数增大总体趋势是逐渐增大.但Al的第一电离能明显低于Mg,原因是Mg的3P轨道为全空状态,而Al的3P轨道为3P1,不是全空,全满或半满状态.
分析 (1)根据构造原理书写出基态锗原子核外电子排布式;
(2)①原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态;
②元素的非金属性越强,其电负性越大;
③根据价层电子对互斥理论确定杂化和离子空间构型,阴阳离子之间存在离子键,非金属元素之间存在共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键;
(3)配位数:中心原子周围的配位原子个数;该配合物的配离子中Cu原子和N原子、氨气分子中N原子和H原子之间都存在σ键;铜离子与氨分子中的氮形成配位键;
(4)同一周期元素中,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素.
解答 解:(1)锗为32号元素,根据构造原理书,基态锗原子核外电子排布式:1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,
故答案为:1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2;
(2)①Ti原子核外有22个电子,所以有22种不同运动状态的电子,
故答案为:22;
②非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
③BH4-中B原子价层电子数=4+$\frac{1}{2}$=4,所以为SP3杂化,且不含孤电子对,是正四面体构型,Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键,
故答案为:正四面体;SP3杂化;C;
(3)[Cu(NH3)4]Cl2中Cu2+与NH3形成4个配位键,所以该配合物的配位数是4,NH3中含有3个N-H键,均为σ键,故1mol[Cu(NH3)4]Cl2含有(4+3×4)mol=16molσ键,则含有σ键的数目为16NA,铜离子有空轨道,氨气分子有孤对电子,铜离子与氨分子中的氮形成配位键,所以配离子[Cu(NH3)4]2+的结构简式为: ,
,
故答案为:4,16NA; ;
;
(4)镁、铝属于同一周期元素,镁的价电子排布是3s2,3p轨道全空较稳定,而铝是3s23p1则不是全满,全空,半空中任意一种情况,不稳定,故铝的第一电离能比镁小,
故答案为:Mg的3P轨道为全空状态,而Al的3P轨道为3P1,不是全空,全满或半满状态.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断、空间构型的判断、配合物、第一电离能大小比较等知识点,易错点是镁、铝第一电离能大小比较,题目难度中等.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 在碱性溶液中:Na+、NH4-、Cl-、NO3- | |
| B. | pH=4的无色溶液中:Na+、Ba2+、Cl-、SO32- | |
| C. | pH=10的无色溶液中:H+、NH4-、HCO3-、Cl- | |
| D. | 中性溶液中:K+、Na+、NO3-、Cl- |
| A. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| B. | 油脂是高分子化台物,水解可生成甘油和高级脂肪酸 | |
| C. | 煤中含有的煤焦油,可由煤干馏获得 | |
| D. | 聚乙烯塑料的老化是因为发生了加成反应 |
| A. | Na和O2 | B. | Fe和稀HNO3 | C. | Cu和FeCl3溶液 | D. | Na2CO3和稀HCl |


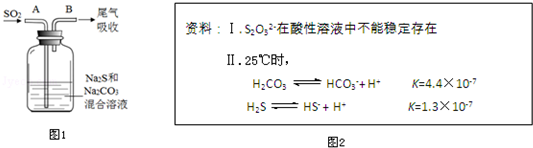
 在实验室里制取乙烯的反应为:
在实验室里制取乙烯的反应为: $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O .
.
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: