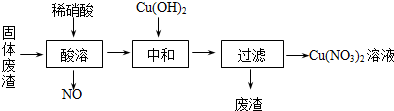
题目内容
10.第三周期元素中,微粒半径最大的是( )| A. | Al3+ | B. | Na+ | C. | S2- | D. | Cl- |
分析 电子层越多的离子半径越大,电子层一样的离子,核电荷数越多半径越小,据此来回答.
解答 解:四种离子中,Na+、Al3+有两个电子层,S2-、Cl-有三个电子层,硫离子和氯离子的电子层数多,半径大,但是硫离子的核电荷数少,所以S2-半径最大,
故选C.
点评 本题考查学生离子半径大小的比较方法知识,注意从电子层数和核电荷数两个角度去分析,注意知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
3.铁和足量稀H2SO4反应时,若铁失去0.2mol电子,则参加的铁的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 11.2g |
1.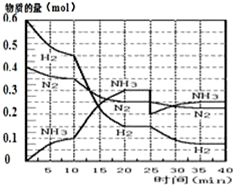 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a>0;△S>0,(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1.
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1.
18.莽草酸结构简式如图.下列说法错误的是( )


| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1 mol该物质与Na反应时,最多消耗Na 4 mol |

 如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:
如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下: