题目内容
10.锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水.当生成1mol Zn(NO3)2时,消耗的硝酸的物质的量为( )| A. | 2mol | B. | 1mol | C. | 2.25 mol | D. | 2.5 mol |
分析 锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水,该反应方程式为4Zn+10HNO3=4Zn(NO3)2+NH4NO3+5H2O,根据硝酸锌和硝酸之间关系式计算.
解答 解:锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水,该反应方程式为4Zn+10HNO3=4Zn(NO3)2+NH4NO3+5H2O,设消耗硝酸的物质的量为x,
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+5H2O
10mol 4mol
x 1mol
10mol:4mol=x:1mol
x=2.5mol
故选D.
点评 本题考查化学方程式有关计算,为高频考点,正确书写方程式是解本题关键,注意该反应中N元素化合价变化,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列有机物中,是1-丙醇在铜的催化作用下被氧化的产物的同分异构体的是( )
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH3CHOHCH3 | D. | CH3CH2COOH |
1.NA为阿伏伽德罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4L CH3OH所含中子数为14NA | |
| B. | 常温常压下,1mol Na2CO3所含CO32-的数目等于NA | |
| C. | 56g Fe与足量水蒸气反应,转移的电子数目为$\frac{8}{3}$NA | |
| D. | 1L pH=0的H2SO4所含H+数目为NA |
18.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性 | |
| D. | 三种分散系中分散质均属于电解质 |
5.mg某双原子分子的气体在标准状况下的体积为V1L,其摩尔质量为Mg/mol,将其溶于水(该气体与水不反应)得到体积为V2L的溶液,NA表示阿伏加德罗常数的值,则下列错误的是( )
| A. | 该气体分子的摩尔质量为$\frac{22.4m}{{V}_{1}}$g/mol | |
| B. | 该气体分子中含有的原子数目为$\frac{{N}_{A}{V}_{1}}{22.4}$g/mol | |
| C. | 该气体溶于水后得到溶液的物质的量浓度为$\frac{m}{M{V}_{2}}$mol/L | |
| D. | 该气体溶于水后得到溶液的物质的量浓度$\frac{{V}_{1}}{22.4{V}_{2}}$mol/L |
15.用惰性电极电解饱和Na2SO4溶液,若保持温度不变,电解一段时间后,下列有关说法正确的是( )
| A. | 溶液的pH变大 | |
| B. | c(Na+)与c(SO42-)的比值不变 | |
| C. | 电解过程中,向阳极附近溶液滴入酚酞,溶液变为红色 | |
| D. | 阴、阳极产生气体在相同条件下体积之比为1:2 |
2.有关甲苯的实验事实中,能说明苯环对侧链性质的影响的是( )
| A. | 甲苯和硝酸反应生成三硝基甲苯 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
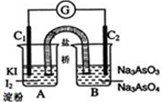 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题: