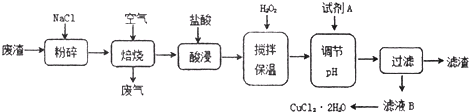
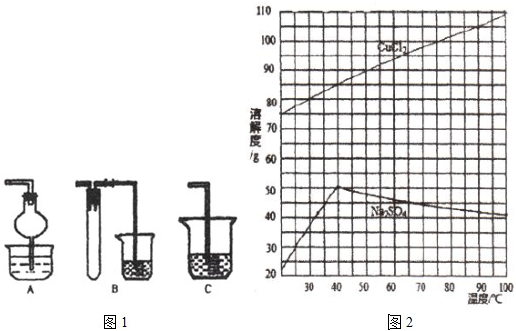
题目内容
| |||||||||||||||
答案:
解析:
解析:
(1) |
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
(3) |
阴极:2H++2e-=H2↑阳极:Fe-2e-=Fe2+ Fe2+~H2n(Fe2+)=n(H2)=0.896L/22.4L·mol-1=0.04mol 若0.04molFe2+全部转化为Fe(OH)3,沉淀的质量至少为4.28g,大于4.24g 废水中Fe2+剩余,CrO72-全部被转化为Cr3+(3分) 设沉淀中Cr(OH)3的物质的量为x,Fe(OH)3的物质的量为y 103g/molx+107g/mol×3x=4.24gx=0.01mol 废水中铬的含量为 |

练习册系列答案
相关题目
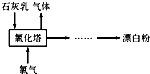 氯气是重要的化工原料.
氯气是重要的化工原料.