题目内容
(2012?闸北区二模)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2?2H2O晶体的工艺流程如下:
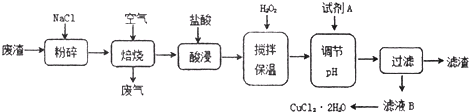
己知:①焙烧过程中发生的主要反应为:CuS+2NaCl+2O2→CuCl2+Na2SO4
请参照表中给出的数据回答:
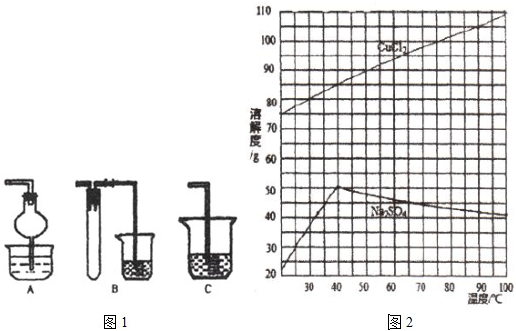
(1)焙烧时还有废气产生,其中一种是主要的大气污染物.若在实验室中以碱液吸收处理之,下列(图1)A、B、C装置中可行的是
(2)H2O2的作用是:
(3)调节溶液pH的范围是
a.KOH b.氨水
c.Cu2(OH)2CO3 d.CuO
(4)为了获得CuCl2?2H2O晶体,对滤液B进行的操作是:
(5)滤液B中除OH-外阴离子还有
(6)请描述检验滤液B中上述阴离子(除OH-外)的实验操作

己知:①焙烧过程中发生的主要反应为:CuS+2NaCl+2O2→CuCl2+Na2SO4
请参照表中给出的数据回答:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
AB
AB
(填字母).
(2)H2O2的作用是:
氧化Fe2+
氧化Fe2+
.(3)调节溶液pH的范围是
3.2至4.7
3.2至4.7
,试剂A可以选择cd
cd
(填写选项字母).a.KOH b.氨水
c.Cu2(OH)2CO3 d.CuO
(4)为了获得CuCl2?2H2O晶体,对滤液B进行的操作是:
蒸发浓缩
蒸发浓缩
,趁热过滤,滤液经冷却结晶,过滤得到产品.分析有关物质的溶解度曲线(如图2),“趁热过滤”得到的固体是Na2SO4
Na2SO4
(填化学式).(5)滤液B中除OH-外阴离子还有
S042- Cl-
S042- Cl-
.(6)请描述检验滤液B中上述阴离子(除OH-外)的实验操作
取少量滤液,先加过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-
取少量滤液,先加过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-
.分析:(1)处理过程中主要是防止液体倒吸,A、B、C装置中防倒吸的是AB;
(2)把Fe2+氧化为Fe3+转化为沉淀出去;
(3)根据Fe3+完全转化为沉淀时的pH分析;调节pH时不能引入杂质;
(4)根据从溶液中获取溶质的方法分析;分析有关物质的溶解度曲线可知高温时CuCl2?溶解度大,Na2SO4 的溶解度小,溶解度小的析出;
(5)根据溶液的成分分析;
(6)根据检验S042-和Cl-的方法分析.
(2)把Fe2+氧化为Fe3+转化为沉淀出去;
(3)根据Fe3+完全转化为沉淀时的pH分析;调节pH时不能引入杂质;
(4)根据从溶液中获取溶质的方法分析;分析有关物质的溶解度曲线可知高温时CuCl2?溶解度大,Na2SO4 的溶解度小,溶解度小的析出;
(5)根据溶液的成分分析;
(6)根据检验S042-和Cl-的方法分析.
解答:解:(1)处理过程中主要是防止液体倒吸,A、B、C装置中防倒吸的是AB;
故答案为:AB;
(2)把Fe2+氧化为Fe3+转化为沉淀出去,所以要加氧化剂,所以H2O2的作用是氧化Fe2+,
故答案为:氧化Fe2+;
(3)根据Fe3+完全转化为沉淀时的PH可知,PH在3.2至4.7时Fe3+完全转化为沉淀,同时铜离子不沉淀;调节pH时不能引入杂质,所以可以选用Cu2(OH)2CO3 和CuO,
故答案为:3.2至4.7;cd;
(4)从溶液中获取溶质的操作为:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品;分析有关物质的溶解度曲线可知高温时CuCl2?溶解度大,Na2SO4 的溶解度小,溶解度小的析出,所以Na2SO4先析出,
故答案为:蒸发浓缩;Na2SO4;
(5)已知溶液的阴离子有S042-,Cl-;析出晶体时离子不能完全析出,所以滤液B中除OH-外阴离子还有S042-,Cl-,
故答案为:S042- Cl-;
(6)检验S042-和Cl-的方法为:取少量滤液,先加入过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-;
故答案为:取少量滤液,先加入过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-.
故答案为:AB;
(2)把Fe2+氧化为Fe3+转化为沉淀出去,所以要加氧化剂,所以H2O2的作用是氧化Fe2+,
故答案为:氧化Fe2+;
(3)根据Fe3+完全转化为沉淀时的PH可知,PH在3.2至4.7时Fe3+完全转化为沉淀,同时铜离子不沉淀;调节pH时不能引入杂质,所以可以选用Cu2(OH)2CO3 和CuO,
故答案为:3.2至4.7;cd;
(4)从溶液中获取溶质的操作为:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品;分析有关物质的溶解度曲线可知高温时CuCl2?溶解度大,Na2SO4 的溶解度小,溶解度小的析出,所以Na2SO4先析出,
故答案为:蒸发浓缩;Na2SO4;
(5)已知溶液的阴离子有S042-,Cl-;析出晶体时离子不能完全析出,所以滤液B中除OH-外阴离子还有S042-,Cl-,
故答案为:S042- Cl-;
(6)检验S042-和Cl-的方法为:取少量滤液,先加入过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-;
故答案为:取少量滤液,先加入过量的硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,检出SO42-;过滤(或静置)再向滤液(或清液)加入适量的AgNO3溶液,也有白色沉淀出现,检出Cl-.
点评:本题考查了物质转化关系和物质性质的应用,主要考查物质分离的流程分析和原理利用,防倒吸的选择,实验基本操作的判断,综合考查学生的实验能力和分析能力,为高考常见题型,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 (2012?闸北区二模)有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )
(2012?闸北区二模)有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )