题目内容
20.根据热化学方裎式S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1分析下列说法中正确的是( )| A. | S(g)+O2(g)═SO2(g)△H<-297.3kJ•mol-1 | |
| B. | 2SO2(g)═2S(s)+2O2(g)△H=+297.3kJ•mol-1 | |
| C. | 1molSO2的键能总和小于1molS和1molO2的键能总和 | |
| D. | 1molSO2具有的总能量大于1molS和1molO2的总能量 |
分析 A、因物质由固态转变成气态也要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的绝对值大于297.23kJ•mol-1,焓变为负值比较大小;
B、S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,反应的逆反应2SO2(g)═2S(s)+2O2(g)△H=+297.3×2kJ•mol-1 =594.62kJ•mol-1;
C、反应焓变△H=反应物总键能之和-生成物总键能总和,反应为放热反应,△H<0;
D、反应为放热反应,所以反应物的总能量高于生成物的总能量.
解答 解:A、因物质由固态转变成气态也要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的绝对值大于297.23kJ•mol-1,焓变为负值,△H<-297.3kJ•mol-1,故A正确;
B、S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1,反应的逆反应2SO2(g)═2S(s)+2O2(g)△H=+297.3×2kJ•mol-1 =594.62kJ•mol-1,故B错误;
C、反应焓变△H=反应物总键能之和-生成物总键能总和,反应为放热反应,△H<0,所以1molSO2的键能总和大于1molS和1molO2的键能总和,故C错误;
D、反应为放热反应,所以反应物的总能量高于生成物的总能量,即1molS(s)与1molO2(g)所具有的能量之和高于1molSO2(g)所具有的能量,故D错误.
故选:A.
点评 本题考查反应热与物质状态的关系、反应热与物质能量的关系,难度不大,注意化学反应中反应热的计算,物质三态之间的转变也存在能量的变化.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
8.在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率.某学生设计实验如下表所示:
(1)该反应的氧化剂是KIO3,若生成1mol I2,转移电子的物质的量是10mol.
(2)V1=40 mL,V2=10 mL.
(3)如果研究Na2SO3溶液浓度对反应速率的影响,使用实验2和实验3.
(4)对比实验1和实验2,可以研究温度对化学反应速率的影响.
(5)溶液出现蓝色所需的时间从大到小的顺序是a>b>c(用a、b、c表示).
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的 体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
(2)V1=40 mL,V2=10 mL.
(3)如果研究Na2SO3溶液浓度对反应速率的影响,使用实验2和实验3.
(4)对比实验1和实验2,可以研究温度对化学反应速率的影响.
(5)溶液出现蓝色所需的时间从大到小的顺序是a>b>c(用a、b、c表示).
5.“嫦娥奔月”是一个充满浪漫主义的中国神话故事.2007年10月24日我国“嫦娥一号”探月卫星由长三甲火箭送入预定的轨道.长三甲火箭第三级推进剂采用低温液氧/液氢.已知在298K时,2g氢气与氧气完全反应生成液态水放热285.8kJ,则此反应的热化学方程式为下列的( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8KJ•mol-1 | |
| D. | H2(g)+O2(g)═H2O(g)△H=-285.8KJ•mol-1 |
9.强酸强碱的稀溶液发生中和反应生成1mol水时放出的热量为57.3kJ.下列热化学方程式正确的是( )
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3kJ/mol. | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+KNO3(aq)△H<-57.3kJ/mol. | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3kJ/mol. | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H>-57.3kJ/mol. |
10. 实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如表:
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=0.0065mol•L-1•min-1,实验2中采取的措施是使用催化剂;实验3中n3>1.0mol(填“>、=、<”).
②比较实验4和实验1,可推测该反应中Q<0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的abd.
a.10~15min可能是升高了温度 b.10~15min可能是加入了催剂
c.20min时可能缩小了容器体积 d.20min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始).反应进行并达到平衡后,测得容器内气体压强为P(始)的$\frac{7}{8}$.若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的$\frac{7}{8}$.
①a、b、c必须满足的关系是a+c=5,b+$\frac{1}{2}$c=3.(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是3<a≤5.
 实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g)?2C(g);?△H=QkJ/mol(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如表:
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 7 0℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
①在实验1中反应在10至20min内反应的平均速率Vc=0.0065mol•L-1•min-1,实验2中采取的措施是使用催化剂;实验3中n3>1.0mol(填“>、=、<”).
②比较实验4和实验1,可推测该反应中Q<0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的abd.
a.10~15min可能是升高了温度 b.10~15min可能是加入了催剂
c.20min时可能缩小了容器体积 d.20min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始).反应进行并达到平衡后,测得容器内气体压强为P(始)的$\frac{7}{8}$.若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的$\frac{7}{8}$.
①a、b、c必须满足的关系是a+c=5,b+$\frac{1}{2}$c=3.(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是3<a≤5.

 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH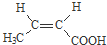 .
. .
.