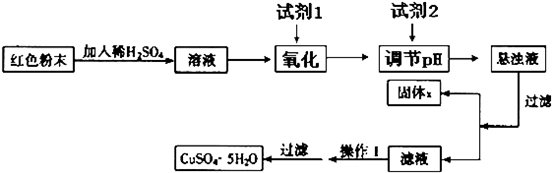
题目内容
纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等.其中电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备.电化学法制备Cu2O时,铜棒做 极,阴极生成Cu2O的电极反应式为: .
考点:电解原理
专题:
分析:电化学法制备Cu2O时,阴极生成Cu2O,铜离子被还原,铜应为阳极,阳极生成铜离子,以补充铜离子.
解答:
解:电化学法制备Cu2O时,阴极生成Cu2O,铜离子被还原,电极方程式为2Cu2++2e-+H2O═Cu2O+2H+,铜应为阳极,阳极生成铜离子,以补充铜离子,
故答案为:阳;2Cu2++2e-+H2O═Cu2O+2H+.
故答案为:阳;2Cu2++2e-+H2O═Cu2O+2H+.
点评:本题考查电解原理,为高频考点,注意把握电极方程式的书写,难度中等.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
能在水溶液中大量共存的一组离子是( )
| A、NH4+、Ag+、NO3-、I- |
| B、Na+、K+、AlO2-、OH- |
| C、Ca2+、Fe2+、ClO-、Cl- |
| D、Mg2+、Al3+、CO32-、SO42- |
从海水中提取镁的工业流程如图所示,下列说法正确的是( )

| A、在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯 |
| B、步骤⑥电解MgCl2时,阴极产生H2 |
| C、步骤⑤应将晶体置于HCl气体氛围中脱水 |
| D、上述工艺流程中的反应未涉及氧化还原反应 |
对于常温下pH=12的氨水,下列说法正确的是( )
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
可逆反应aA(g)+bB(g)?cC(g)+dD(g)△H=Q,同时符合下列两图中各曲线的规律的是( )

| A、a+b>c+d T1<T2 Q<0 |
| B、a+b>c+d T1>T2 Q>0 |
| C、a+b<c+d T1>T2 Q>0 |
| D、a+b>c+d T1>T2 Q<0 |
 N2O5是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:(隔膜不允许水分子通过,H+可以通过)下列说法正确的是( )
N2O5是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:(隔膜不允许水分子通过,H+可以通过)下列说法正确的是( )| A、Y是负极,电极反应式:H2O2+2e-=2OH- |
| B、Z是阳极,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+ |
| C、电流从X流出经导线流入W极 |
| D、制备10.8gN2O5至少需要消耗硼氢化钠0.87g |