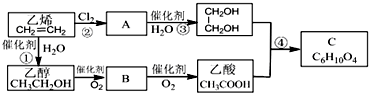
题目内容
16.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
分析 A.同主族元素最高价含氧酸自上而下酸性减弱;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.同主族元素的单质从上到下,非金属性减弱,金属熔点降低,非金属熔点升高;
D.同一主族的两种元素的原子序数之差为2、8、8、18、18、32等.
解答 解:A.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故A错误;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,故C错误;
D.同一主族相邻的两种元素的原子序数之差为2、8、8、18、18、32等,所以可能为32,故D正确.
故选:D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素周期律、周期表中的族序数、原子序数等关系为解答的关键,题目难度不大.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
6.下列有机化合物中含有手性碳原子的是( )
| A. | 乙醇(CH3CH2OH) | B. | 甘油(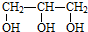 ) ) | C. | 乳酸(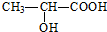 ) ) | D. | 苯乙烯(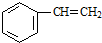 ) ) |
4.NH5属于离子化合物,与水反应的化学方程式为:NH5+H2O=NH3.H2O+H2↑,有关NH5叙述正确的是( )
| A. | NH5的电子式: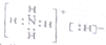 | |
| B. | NH5中N元素的化合价为+5价 | |
| C. | 1molNH5中含有5molN-H键 | |
| D. | 1molNH5与H2O完全反应,转移电子2mol |
11.下列说法正确的是( )
| A. | 单质分子中一定含有共价键 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 活泼金属与活泼非金属化合时,一定形成离子键 | |
| D. | 只含非金属元素的化合物一定不是离子化合物 |
8.下列说法中,不正确的是( )
| A. | 石油裂解产物中有乙烯 | |
| B. | 天然气的主要成分是乙烯 | |
| C. | 芳香烃主要来自于煤干馏产生的煤焦油 | |
| D. | 汽油、煤油、柴油主要来自于石油的常压分馏 |
6.下列有关实验的叙述正确的是( )
| A. | 将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系,n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 | |
| B. | 实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L | |
| C. | HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 | |
| D. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
 ,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素.
,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素. .
.