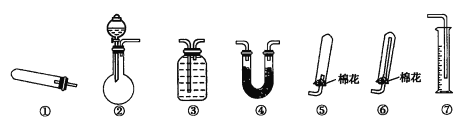
��Ŀ����
����Ŀ��ijͬѧ����98%��ŨH2SO4(��=1.84g/cm3)���Ƴ�500 mL 0.5 mol/L��ϡH2SO4��
(1)��д���в������裺
������ŨH2SO4�����Ϊ_________
�����ʵ������10 mL��20 mL��50 mL��Ͳ��Ӧѡ��____________mL��Ͳ��ȡ��
�۽���ȡ��ŨH2SO4�ز���������ע��ʢ��Լ100 mLˮ��___������Ͻ��裬Ŀ����____��
��������������Һ�ز�����ע��_______�У�����50 mL����ˮϴ���ձ�2��3�Σ�����ϴ��Һע�����У�����ʱ������
�ݼ�ˮ����̶�_______��������______��ˮ��ʹ��Һ�İ�Һ�����ø��̶���ƽ������ƿ�������µߵ����Σ�ҡ�ȡ�
(2)��ָ������������һ�����Դ���________��
(3)���(��ƫ�ߡ�ƫ�͡���Ӱ��)
����������ȡʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ��������ҺŨ�Ƚ�_________��������ƿ��ϴ����δ�����������ˮ���������Ƶ���ҺŨ�Ƚ�_________���������У�������ʱ���۾����ӣ��������Ƶ���ҺŨ�Ƚ�_________��
(4)��һ��, һ�����ʵ���Ũ����Һ������
һ����Ҫ������ _________��һ������������_________��
���𰸡�13.6 mL 20 �ձ� ɢ�ȣ���ֹҺ��ɽ� 500mL����ƿ 1��2 cm ��ͷ�ι� �ڢܲ���Һδ��ȴ ƫ�� ��Ӱ�� ƫ�� ��ƽ(������)��ҩ�ס���Ͳ���ձ�������������ͷ�ιܡ�һ����������ƿ ���㡢����(����ȡ)���ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ��
��������
(1)�ٸ������ʵ���Ũ����������������ʽc=![]() ����98%�����ʵ���Ũ�ȣ�Ȼ��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬������ҪŨ����������
����98%�����ʵ���Ũ�ȣ�Ȼ��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬������ҪŨ����������
��ѡ����Ͳ���ʱԭ���� ������������ݴ�ѡ������Ͳ���
��ϡ��Ũ��Һ���������ձ���Ũ����ϡ�ͷ��ȣ��ò����������Ŀ����ʹ��Ͼ��ȣ�ʹ����Ѹ����ɢ��
����Һ�ǽ�ϡ�Ͳ���ȴ�õ���Һת�Ƶ�����ƿ�У�
�ݶ���ʱ��ֱ�Ӽ�������ˮ����̶� 1��2 cm�������ý�ͷ�ιܶ��ݣ�
(2)Ũ����ϡ�ͷ��ȣ��ȵ���Һ���ƫ��
(3)����c=![]() ��������ʵ����ʵ���n����Һ�����V�ı仯����ʵ����
��������ʵ����ʵ���n����Һ�����V�ı仯����ʵ����
(4)��������һ�����һ�����ʵ���Ũ�ȵ���Һ����ȷ��ʹ�õ�������
(1)��98%��Ũ��������ʵ���Ũ��Ϊc=![]() mol/L=18.4 mol/L��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬��֪����500 mL 0.5 mol/L��ϡH2SO4��ҪŨ��������V(H2SO4)=
mol/L=18.4 mol/L��������Һ��ϡ��ǰ�����ʵ����ʵ������䣬��֪����500 mL 0.5 mol/L��ϡH2SO4��ҪŨ��������V(H2SO4)= ![]() =13.6 mL��
=13.6 mL��
����ҪŨ����������13.6 mL���������������ԭ��Ӧѡ�ù��Ϊ20 mL����Ͳ��
��ϡ��Ũ����Ӧ�����ձ��н��У�����ȡ��ŨH2SO4�ز���������ע��ʢ��Լ100 mLˮ���ձ��У�����Ũ��������ˮ��ų��������ȣ�Ϊ��ɢ�ȣ���ֹҺ��ɽ�����Ҫ�ò��������Ͻ��裻
������500 mL 0.5 mol/L��ϡH2SO4��Ҫѡ�ù��Ϊ500 mL����ƿ����Ӧ�ý�ϡ�Ͳ���ȴ�õ���Һת�Ƶ�500 mL����ƿ�У�����50 mL����ˮϴ���ձ�2��3�Σ�����ϴ��Һע�����У�����ʱ������
�ݶ��ݵIJ����ǿ�ʼֱ��������ƿ�м�ˮ����ˮ����̶� 1��2 cm�������ý�ͷ�ι���μ����ˮ��ʹ��Һ�İ�Һ�����ø��̶���ƽ������ƿ�������µߵ����Σ�ҡ�ȣ�
(2)Ũ����ϡ�ͷ��ȣ�����ƿʹ�õ��¶������£��ȵ���Һ��Ӱ��������Һ����������ܽ��ȵ���Һֱ��ת��������ƿ�У�Ӧ��ϡ�ͺ����Һ��ȴ�����£�Ȼ���ٽ�����Һ����������������һ�����Դ����ǵڢܲ���û����ȴ��
(3)����������ȡʱ������Ͳ���ɾ�����ˮϴ����ֱ����ȡ�ᵼ��Ũ���ᱻϡ�ͣ���ȡ��Ũ��������ʵ���ƫС��������ҺŨ�Ƚ�ƫ�ͣ�������ƿδ���T����������Һ�����ڲ�Ӱ�����ʵ����ʵ�������Һ����������Զ�������Һ��Ũ����Ӱ�죻�������У�������ʱ���۾����ӣ��ᵼ����Һ���ƫС���������ʵ����ʵ������䣬��˻ᵼ�������Ƶ���ҺŨ��ƫ�ߣ�
(4)����һ�������һ�����ʵ���Ũ����Һ�IJ����У����㡢����(����ȡ)���ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�����ȡʱҪʹ����Ͳ�����ܽ�����ʱҪʹ���ձ���������������ҺʱҪʹ��һ���������ƿ�����������������ʱҪʹ�ý�ͷ�ιܣ����Ҫʹ��Һ����������һ�����ʵ���Ũ�ȵ���Һʱʹ�õ������У���Ͳ���ձ�������������ͷ�ιܡ�һ����������ƿ��������Ϊ���壬����Ҫʹ��������ƽ(������)��ҩ�ף���һ������£�����һ�����ʵ���Ũ����Һʹ�õ������У�������ƽ(������)��ҩ�ס���Ͳ���ձ�������������ͷ�ιܡ�һ����������ƿ��