题目内容
8.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
分析 A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1<△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1<△H2,故B错误;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C正确;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,△H1<△H2,故D错误;
故选C.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
1.下列关于NaHCO3溶液的叙述正确的是( )
| A. | NaHCO3俗名纯碱,其水溶液显弱碱性 | |
| B. | 该溶液中K+、Al3+、SO42-可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
3.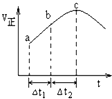 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应在c点达到平衡状态 | |
| B. | △t1=△t2时,N2的转化量:a~b段小于b~c段 | |
| C. | C点反应放出的热量达到最大 | |
| D. | 反应物浓度:a点小于b点 |
13.下列有机物命名正确的是( )
| A. | 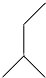 (2-乙基丙烷) (2-乙基丙烷) | B. | CH3CH2CH2CH2OH(1-丁醇) | ||
| C. |  (间二甲苯) (间二甲苯) | D. | CH3C(CH3)=CH2(2-甲基-2-丙烯) |
20. SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
Ⅰ.一种制备SOCl2的常用方法是:SO3+SCl2=SOCl2+SO2,其模拟装置如图所示(夹持装置略去),各物质的部分性质如下:
(1)A装置是由水槽、温度计、蒸馏烧瓶和分液漏斗组装而成的,当蒸馏烧瓶中反应物出现
樱桃红色变为无色现象时,说明反应完成,停止滴加SO3.
(2)B中所盛药品是浓硫酸,装置C中药品及选择该药品的作用分别是氢氧化钠、吸收尾气.
(3)反应后将A中混合物进行蒸馏,收集到较纯净的产品,需控制蒸馏温度在C左右.
a.44.8℃b.59℃c.76℃
Ⅱ.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2,回答下列问题:
(4)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(5)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(6)若含金属锂6.9g的电池质量为m g,平均电压为n V,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含有m、n的代数式,系数用科学计数法表示,结果保留三个有效数字:比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1).
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.Ⅰ.一种制备SOCl2的常用方法是:SO3+SCl2=SOCl2+SO2,其模拟装置如图所示(夹持装置略去),各物质的部分性质如下:
| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
樱桃红色变为无色现象时,说明反应完成,停止滴加SO3.
(2)B中所盛药品是浓硫酸,装置C中药品及选择该药品的作用分别是氢氧化钠、吸收尾气.
(3)反应后将A中混合物进行蒸馏,收集到较纯净的产品,需控制蒸馏温度在C左右.
a.44.8℃b.59℃c.76℃
Ⅱ.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2,回答下列问题:
(4)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(5)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(6)若含金属锂6.9g的电池质量为m g,平均电压为n V,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含有m、n的代数式,系数用科学计数法表示,结果保留三个有效数字:比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1).
18.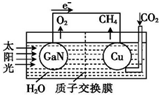 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )| A. | 该装置只有化学能转化为电能 | |
| B. | 氮化镓电极是阴极 | |
| C. | 导线中经过2mol的电子,氮化镓电极生成1molO2 | |
| D. | 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O |
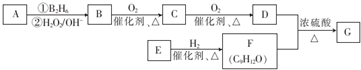
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应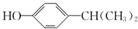
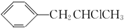 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):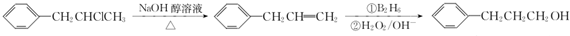 .
.