题目内容
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B (g)?xC(g).请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol?L-1.
①1min内,B的平均反应速率为 ;x= ;
②若反应经2min达到平衡,平衡时C的浓度 0.8mol?L-1 (填“大于”、“等 于”或“小于”);
③平衡混合物中,C的体积分数为20%,则A的转化率是 ;
(2)若维持容器压强不变,达到平衡时C的体积分数 20%,(填“大于”、“等于”或“小于”);
(3)①若维持反应的温度不变,到达平衡时,C的浓度为0.6mol?L-1,则K= .
②若体系的温度下降,K值减小,则该反应是 反应.(填“吸热”、“放热”)
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol?L-1.
①1min内,B的平均反应速率为
②若反应经2min达到平衡,平衡时C的浓度
③平衡混合物中,C的体积分数为20%,则A的转化率是
(2)若维持容器压强不变,达到平衡时C的体积分数
(3)①若维持反应的温度不变,到达平衡时,C的浓度为0.6mol?L-1,则K=
②若体系的温度下降,K值减小,则该反应是
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则
①A的反应速率为
=0.6mol/(L?min),C的反应速率为
=0.4mol/(L?min),结合反应速率之比等于化学计量数之比计算;
②随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,反应速率应小于1min时,1min时,C的浓度为0.4mol/L,则则平衡时C的浓度小于0.8mol/L;
③3A(g)+B (g)?2C(g)
开始 1.5 0.5 0
转化 3x x 2x
平衡 1.5-3x 0.5-x 2x
平衡混合物中,C的体积分数为20%,则
×100%=20%,以此计算;
(2)若维持恒温恒压下:相对恒容来说,恒压下发生该反应气体的物质的量减小,体积减小,相当于加压,平衡正向移动;
(3)①根据三段式:
3A(g)+B (g)?2C(g)
开始浓度 1.5 0.5 0
转化浓度 0.9 0.3 0.6
平衡浓度 0.6 0.2 0.6,K=
=
=8.3;
②若体系的温度下降,K值减小,平衡向放热即逆反应方向移动,则该反应是吸热反应.
①A的反应速率为
| 3mol-1.8mol |
| 2L?1min |
| 0.4mol/L |
| 1min |
②随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,反应速率应小于1min时,1min时,C的浓度为0.4mol/L,则则平衡时C的浓度小于0.8mol/L;
③3A(g)+B (g)?2C(g)
开始 1.5 0.5 0
转化 3x x 2x
平衡 1.5-3x 0.5-x 2x
平衡混合物中,C的体积分数为20%,则
| 2x |
| 1.5-3x+0.5-x+2x |
(2)若维持恒温恒压下:相对恒容来说,恒压下发生该反应气体的物质的量减小,体积减小,相当于加压,平衡正向移动;
(3)①根据三段式:
3A(g)+B (g)?2C(g)
开始浓度 1.5 0.5 0
转化浓度 0.9 0.3 0.6
平衡浓度 0.6 0.2 0.6,K=
| c2(C) |
| c3(A)?c(B) |
| 0.62 |
| 0.63×0.2 |
②若体系的温度下降,K值减小,平衡向放热即逆反应方向移动,则该反应是吸热反应.
解答:
解:(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则
①A的反应速率为
=0.6mol/(L?min),C的反应速率为
=0.4mol/(L?min),
由反应速率之比等于化学计量数之比可知,B的平均反应速率为0.2mol/(L?min),x=2,
故答案为:0.2mol/(L?min);2;
②随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,反应速率应小于1min时,1min时,C的浓度为0.4mol/L,则则平衡时C的浓度小于0.8mol/L,
故答案为:小于;
③3A(g)+B (g)?2C(g)
开始 1.5 0.5 0
转化 3x x 2x
平衡1.5-3x 0.5-x 2x
平衡混合物中,C的体积分数为20%,则
×100%=20%,
解得3x=0.5,
则A的转化率为
×100%=33.3%,
故答案为:33.3%;
(2)容器体积固定时C的体积分数为20%,若维持容器压强不变,应缩小体积,平衡向正方向移动,则达到平衡时C的体积分数大于20%,
故答案为:大于;
(3)①根据三段式:
3A(g)+B (g)?2C(g)
开始浓度 1.5 0.5 0
转化浓度 0.9 0.3 0.6
平衡浓度 0.6 0.2 0.6,K=
=
=8.3;故答案为:8.3;
②若体系的温度下降,K值减小,平衡向放热即逆反应方向移动,则该反应是吸热反应;故答案为:吸热.
①A的反应速率为
| 3mol-1.8mol |
| 2L?1min |
| 0.4mol/L |
| 1min |
由反应速率之比等于化学计量数之比可知,B的平均反应速率为0.2mol/(L?min),x=2,
故答案为:0.2mol/(L?min);2;
②随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,反应速率应小于1min时,1min时,C的浓度为0.4mol/L,则则平衡时C的浓度小于0.8mol/L,
故答案为:小于;
③3A(g)+B (g)?2C(g)
开始 1.5 0.5 0
转化 3x x 2x
平衡1.5-3x 0.5-x 2x
平衡混合物中,C的体积分数为20%,则
| 2x |
| 1.5-3x+0.5-x+2x |
解得3x=0.5,
则A的转化率为
| 0.5 |
| 1.5 |
故答案为:33.3%;
(2)容器体积固定时C的体积分数为20%,若维持容器压强不变,应缩小体积,平衡向正方向移动,则达到平衡时C的体积分数大于20%,
故答案为:大于;
(3)①根据三段式:
3A(g)+B (g)?2C(g)
开始浓度 1.5 0.5 0
转化浓度 0.9 0.3 0.6
平衡浓度 0.6 0.2 0.6,K=
| c2(C) |
| c3(A)?c(B) |
| 0.62 |
| 0.63×0.2 |
②若体系的温度下降,K值减小,平衡向放热即逆反应方向移动,则该反应是吸热反应;故答案为:吸热.
点评:本题综合考查化学平衡的计算,题目难度不大,注意利用三段式法解答该题.

练习册系列答案
相关题目
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
| A、滴定过程中,初读数平视,末读数俯视 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤石灰石;⑥浓HNO3,其中在一定条件下能与SiO2反应的有( )
| A、①②⑥ | B、全部 |
| C、①③④⑤ | D、②③⑥ |
在下列溶液中,Cl-物质的量浓度相同的是( )
| A、1L 0.2 mol/L A1C13溶液 |
| B、100ml 0.3 mol/L MgCl2溶液 |
| C、0.5L 0.1 mol/L NaCl溶液 |
| D、1L 0.3 mol/L HC1溶液 |
某500mL溶液中含0.2molFe2+、0.4molFe3+,加入0.4molFe,待反应完全后,溶液中亚铁离子的物质的量浓度为( )
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
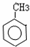

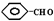
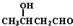


 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)