题目内容
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
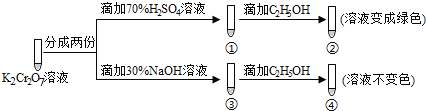
结合实验,下列说法错误的是( )
A.①中溶液橙色加深,③中溶液变黄B.对比②和④可知K2Cr2O7酸性溶液氧化性强
C.②中C2H5OH使Cr2O72-被氧化D.若向④中加入70%H2SO4溶液至过量,溶液可变为绿色
【答案】C
【解析】
A.加入70%H2SO4溶液,H+浓度增大,平衡逆向移动,Cr2O72-浓度增大,所以①中橙色加深,滴加氢氧化钠溶液消耗了H+,H+浓度减小,平衡正向移动CrO42-浓度增大,③中溶液变黄,不满足题目要求,A项错误;
B.②中K2Cr2O7被乙醇还原成三价铬离子呈现绿色,④中溶液不变色,CrO42-没有改变,说明酸性条件下, K2Cr2O7的氧化性更强,不满足题意,B项错误;
C. ②中C2H5OH使Cr2O72-被还原,满足题意,C项正确;
D.向④中加入70%H2SO4溶液至过量,溶液呈酸性,酸性条件下,K2Cr2O7的氧化性强,可被C2H5OH还原变为绿色,不满足题意,D项错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在国庆70周年庆典上,空中飞过的歼击机编队让我们热血沸腾,其中有中国自主研制的最先进的歼20隐形超音速飞机。当超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层,,或许通过测定局部的臭氧浓度变化可使飞机不再“隐形”。因此科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。请回答下列问题:
2CO2(g)+N2(g) △H<0。请回答下列问题:
(1)该反应的平衡常数表达式为___________________________。
(2)假设在闭容器发生上述反应,达到平衡后采取下列选项的措施既能加快反应速率又能提高NO转化率的是_____________。
A.选用更有效的催化剂同时增加CO的量 B.升高反应体系的温度
C.及时加入碱石灰 D.缩小容器的体积
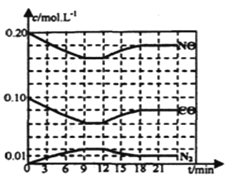
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学将等物质的量的NO和CO充入容积为2L的恒容密闭容器中,设计了三组实验,部分实验数据已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/mol·L-1 | NO平衡浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
Ⅰ | 280 | 0.3 | 0.1 | 82 |
Ⅱ | T1 | c1 | c2 | 124 |
Ⅲ | 350 | c3 | c4 | 124 |
①在上述表格的实验条件数据中,T1=____________,c3=_____________。
②平衡时若保持温度T1℃不变,再向容器中充入CO和CO2各0.2mol,则平衡将_________移动(填“向左”“向右”或“不”)

③在给出的坐标图中,画出了上表中的I、Ⅱ、Ⅲ实验条件下建立平衡过程中,混合气体里NO浓度随时间变化的趋势曲线图,请说出B曲线对应的实验编号__________(填Ⅱ、Ⅲ)。

(4)在恒温恒容的密闭容器中通入n(NO):n(CO)=1:3的混合气体,发生上述反应,下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是__________(选填字母)。