题目内容
计算题
已知:CO(g)+
O2(g)=CO2(g)△H=-283kJ?mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ?mol-1,H2(g)+
O2(g)=H2O(g)△H=-241.8kJ?mol-1
1.792L(标准状况)的CO、CH4和O2组成的混合气体在量热器中燃烧,放出13.683KJ的热量.若向燃烧产物中再加入一定量的H2使之燃烧完全,又放出9.672KJ热量.求原混合物中各气体的体积.
已知:CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
1.792L(标准状况)的CO、CH4和O2组成的混合气体在量热器中燃烧,放出13.683KJ的热量.若向燃烧产物中再加入一定量的H2使之燃烧完全,又放出9.672KJ热量.求原混合物中各气体的体积.
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据1.792L(标准状况)的CO、CH4和O2组成的混合气体在量热器中燃烧,放出13.683KJ的热量,结合题干中提供的方程式中反应热求出混合气体中CO、CH4的物质的量,再根据若向燃烧产物中再加入一定量的H2使之燃烧完全,说明氧气过量,又放出9.672KJ热量结合氢气和氧气的反应热求出原混合物中各气体的体积.
解答:
解:1.792L(标准状况)的CO、CH4和O2组成的混合气体的物质的量为n=
=
=0.08mol,设混合气体中CO、CH4的物质的量分别为x、y,依据①CO(g)+
O2(g)=CO2(g)△H=-283kJ?mol-1;②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ?mol-1,可知:283x+802.3y=13.683KJ,若向燃烧产物中再加入一定量的H2使之燃烧完全,又放出9.672KJ热量,说明氧气过量,设通入参加反应的氢气的物质的量为Z,根据③H2(g)+
O2(g)=H2O(g)△H=-241.8kJ?mol-1,241.8ZkJ=9.672KJ,解得Z=0.04mol,则与之反应的氧气为0.02mol,CO、CH4和O2组成的混合气体0.08mol,恰好反应时物质的量为0.08mol-0.02mol=0.06mol,则依据能量守恒、恰好反应时物质的量列式得:
解得
,
则原混合物中CO的标准状况下体积为0.02mol×22.4L/mol=0.448L,CH4标准状况下体积为0.01mol×22.4L/mol=0.224L,氧气标准状况下体积为1.792L-0.448L-0.224L=1.12L,
答:原混合物中CO、CH4和O2标准状况下体积分别为0.448L、0.224L、1.12L.
| v |
| vm |
| 1.792L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
|
|
则原混合物中CO的标准状况下体积为0.02mol×22.4L/mol=0.448L,CH4标准状况下体积为0.01mol×22.4L/mol=0.224L,氧气标准状况下体积为1.792L-0.448L-0.224L=1.12L,
答:原混合物中CO、CH4和O2标准状况下体积分别为0.448L、0.224L、1.12L.
点评:本题考查根据热化学方程式进行的有关反应热的计算,理顺CO、CH4和O2的关系式解答的关键,题目难度中等.

练习册系列答案
相关题目
下列反应中Fe3+离子表现氧化性的是( )
| A、FeCl3溶液能使KI淀粉试纸变蓝 |
| B、FeCl3溶液滴入沸水中产生红褐色的胶体 |
| C、FeCl3溶液中加入AgNO3溶液产生白色沉淀 |
| D、FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
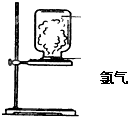 如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题: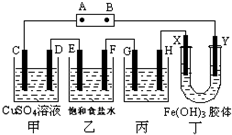 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.