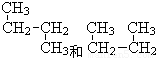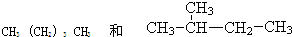题目内容
将在120℃、1.01×105 Pa的条件下由烃A和烯烃B(烯烃即类似于乙烯的烃,其分子组成为CnH2n型)组成的2 L混合气体,与足量的氧气混合并点燃使A、B完全燃烧.恢复到原来的温度和压强时测得生成4 L二氧化碳和4.8 L水.
A的结构简式是________、B的结构简式是________,B在A、B混合气体中所占的体积分数是________.
答案:
解析:
提示:
解析:
|
答案:CH3CH3 CH2=CH2 40% 解析:分子组成为CnH2n型的烃完全燃烧生成的二氧化碳气体与水蒸气的体积比是1∶1,而A、B完全燃烧生成的二氧化碳气体与水蒸气的体积比是4∶4.8,这说明A、B混合物的平均化学式是C2H4.8.分子里的H原子数小于4.8的烯烃只有CH2=CH2.由A、B混合物的平均化学式C2H4.8和CH2=CH2,可知A必是CH3CH3.设CH3CH3与CH2=CH2的体积比是a∶b,则 (4a+6b)/(a+b)=4.8 a∶b=3∶2 所以乙烯的体积分数= |
提示:
|
巧妙、充分地利用物质的化学式的特点进行物质的推断. |

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目



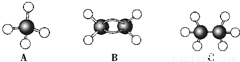
 填空 (1)现有A、B、C三种烃,其球棍模型如图:
填空 (1)现有A、B、C三种烃,其球棍模型如图: ;⑥
;⑥

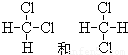 ;⑥
;⑥