题目内容
5.金刚石和石墨是碳元素的两种结构不同的单质.在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )| A. | 石墨和金刚石不能相互转化 | |
| B. | 金刚石比石墨稳定 | |
| C. | 破坏1mol金刚石中的共价键消耗的能量比石墨多 | |
| D. | 1 mol石墨比1 mol金刚石的总能量低 |
分析 在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,能量低的物质稳定;化学变化的特征是生成新物质.
解答 解:1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量
A、金刚石和石墨是同素异形体,同素异形体之间的转化属于化学变化,故A错误;
B、石墨的能量比金刚石低,能量越低越稳定,石墨比金刚石稳定,故B错误;
C、石墨的能量比金刚石低,破坏1mol金刚石中的共价键消耗的能量比石墨少,故C错误;
D、金刚石比石墨能量高,即1 mol石墨比1 mol金刚石的总能量高,故D正确;
故选:D.
点评 本题主要考查金刚石和石墨的转化以及涉及到的能量变化,难度不大,需要掌握的是能量低的物质稳定.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列说法正确的是( )
| A. | 在紫外线、饱和Na2SO4、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 | |
| B. | 油脂属于高分子化合物,是混合物 | |
| C. | 在一定条件下,氨基酸之间能发生反应,合成更加复杂的化合物 | |
| D. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热,观察是否有砖红色沉淀 |
13.制备下列气体过程中,净化除杂的有关操作(括号内是杂质),正确的是( )
| A. | CO2(CO):气体通过灼热的CuO | |
| B. | Cl2(SO2):通入盛有品红溶液的洗气瓶 | |
| C. | NO(NO2):通过水洗,再干燥后,用向下排空气法收集 | |
| D. | H2(CO2):依次通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
10.下列物质中,属于电解质的是( )
| A. | Fe | B. | H2SO4 | C. | CH4 | D. | 酒精 |
17.用NA表示阿佛加德罗常数的值,下列说法正确的是( )
| A. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有2 NA个碳原子 | |
| B. | 7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 1molCH4O中含有C-H键的数目为4NA |
14.某小组利用H2O2溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.
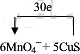
(1)已知反应后H2O2转化为O2逸出,KMnO4转化为MnSO4,请写出该反应的离子方程式5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O.
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.01 mol•L-1•min-1.
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
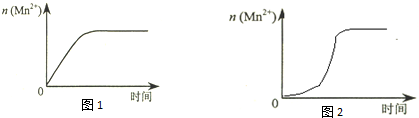
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验①比较,溶液褪色所需时间短(或所用时间(t)小于40s).
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.01 mol•L-1•min-1.
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | 再向试管中加入少量固体 | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | |||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | |

 .
.
 )中的π键不能自由旋转,因此CH3CH=CHCH3有两种顺反异构体.苏丹红Ⅰ号的分子结构如图1所示,分子中所有原子有(填“有”或“不”)可能在同一平面上.它的另一顺反异构体的结构简式为
)中的π键不能自由旋转,因此CH3CH=CHCH3有两种顺反异构体.苏丹红Ⅰ号的分子结构如图1所示,分子中所有原子有(填“有”或“不”)可能在同一平面上.它的另一顺反异构体的结构简式为 .苏丹红Ⅰ号在水中的溶解度很小,微溶于乙醇,若把羟基取代在对位形成图2所示结构,则其溶解度会增大,熔点升高(填“升高”或“降低”).下面两种物质的物理性质存在上述差异的原因可能是苏丹红I号形成分子内氢键,而修饰后的分子形成分子间氢键,分子间氢键有利于增加分子间作用力,从而有利于增大化合物的溶解度和提高熔点.
.苏丹红Ⅰ号在水中的溶解度很小,微溶于乙醇,若把羟基取代在对位形成图2所示结构,则其溶解度会增大,熔点升高(填“升高”或“降低”).下面两种物质的物理性质存在上述差异的原因可能是苏丹红I号形成分子内氢键,而修饰后的分子形成分子间氢键,分子间氢键有利于增加分子间作用力,从而有利于增大化合物的溶解度和提高熔点.