题目内容
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下列措施可以提高H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)= mol/(L?min),平衡常数K= .
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) .
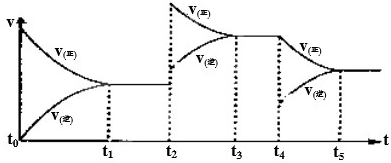
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: .
(5)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
(6)直接供氨式碱性燃料电池的电池反应式是4NH3+3O2═2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 .从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充碱(KOH).
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,下列措施可以提高H2的转化率是(填选项序号)
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)=
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)

a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:
(5)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
(6)直接供氨式碱性燃料电池的电池反应式是4NH3+3O2═2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是
考点:化学平衡的影响因素,热化学方程式,常见化学电源的种类及其工作原理,化学平衡常数的含义,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)转化率是消耗量占起始量的百分比;
a、催化剂改变反应速率不改变化学平衡;
b、增大压强平衡向气体体积缩小的方向进行;
c、分离出氨气平衡正向进行;
d、反应是放热反应升温平衡逆向进行;
(2)依据化学平衡三段式列式计算,反应速率V=
,平衡常数用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(3)2NO(g)+O2(g)?2NO2(g))△H>0.反应是气体体积减小的吸热反应;
a、压强不变说明反应达到平衡;
b、反应是吸热反应升温正逆反应速率增大,平衡正向进行;
c、反应中气体质量守恒,体积不变,过程中密度不变;
d、依据图象分析器内NO2的体积分数在t3~t4时最大;
(4)次氯酸钠与氨气反应,根据NaClO氧化NH3可以得到肼来书写方程式;
(5)依据热化学方程式和盖斯定律计算所需让化学方程式,结合热化学方程式定量关系计算;
(6)燃料电池中,负极是燃料发生失电子的氧化反应.
a、催化剂改变反应速率不改变化学平衡;
b、增大压强平衡向气体体积缩小的方向进行;
c、分离出氨气平衡正向进行;
d、反应是放热反应升温平衡逆向进行;
(2)依据化学平衡三段式列式计算,反应速率V=
| △c |
| △t |
(3)2NO(g)+O2(g)?2NO2(g))△H>0.反应是气体体积减小的吸热反应;
a、压强不变说明反应达到平衡;
b、反应是吸热反应升温正逆反应速率增大,平衡正向进行;
c、反应中气体质量守恒,体积不变,过程中密度不变;
d、依据图象分析器内NO2的体积分数在t3~t4时最大;
(4)次氯酸钠与氨气反应,根据NaClO氧化NH3可以得到肼来书写方程式;
(5)依据热化学方程式和盖斯定律计算所需让化学方程式,结合热化学方程式定量关系计算;
(6)燃料电池中,负极是燃料发生失电子的氧化反应.
解答:
解:(1)a.选择适当的催化剂,加快反应速率,不影响平衡移动,H2的转化率不变,故a错误;
b.增大压强,平衡向正反应移动,H2的转化率增大,故b正确;
c.及时分离生成的NH3,生成物浓度降低,平衡向正反应移动,H2的转化率增大,故c正确;
d.升高温度,平衡向逆反应移动,H2的转化率降低,故d错误;
故答案为:bc;
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1.2 1.6 0
变化量(mol) 0.2 0.6 0.4
平衡量 (mol) 1.0 1.0 0.4
则反应速率v(N2)=
=0.01mol/L?min;
平衡常数K=
=0.64;
故答案为:0.01;0.64;
(3)2NO(g)+O2(g)?2NO2(g)△H>0,反应是气体体积减小的放热反应,
a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡,故a正确;
b.正反应是放热反应,升高温度平衡向逆反应移动,在t2时,正、逆速率都增大,且正反应速率增大更多,平衡向正反应移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应进行,转化率增大,不是升温变化,故b错误;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态,故c错误;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值的最大,故d正确;
故选ad;
(4)制备肼的方法,是以NaClO氧化NH3,反应中还原剂与氧化剂的物质的量之比为2:1,制得肼的稀溶液,反应为NaClO+2NH3
N2H4+H2O+NaCl,
故答案为:NaClO+2NH3
N2H4+H2O+NaCl;
(5))①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.2kJ/mol;
则17g 即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
×905.2kJ=226.3kJ,
故答案为:226.3kJ;
(6)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,即2NH3-6e-+6OH-═N2+6H2O,正极反应为:O2+2H2O+4e-=4OH-,依据电子守恒分析,正负极反应和生成的氢氧根离子相同,理论上分析不需要补充氢氧化钾溶液,
故答案为:2NH3-6e-+6OH-═N2+6H2O;不需要.
b.增大压强,平衡向正反应移动,H2的转化率增大,故b正确;
c.及时分离生成的NH3,生成物浓度降低,平衡向正反应移动,H2的转化率增大,故c正确;
d.升高温度,平衡向逆反应移动,H2的转化率降低,故d错误;
故答案为:bc;
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1.2 1.6 0
变化量(mol) 0.2 0.6 0.4
平衡量 (mol) 1.0 1.0 0.4
则反应速率v(N2)=
| ||
| 10min |
平衡常数K=
(
| ||||
|
故答案为:0.01;0.64;
(3)2NO(g)+O2(g)?2NO2(g)△H>0,反应是气体体积减小的放热反应,
a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡,故a正确;
b.正反应是放热反应,升高温度平衡向逆反应移动,在t2时,正、逆速率都增大,且正反应速率增大更多,平衡向正反应移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应进行,转化率增大,不是升温变化,故b错误;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态,故c错误;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值的最大,故d正确;
故选ad;
(4)制备肼的方法,是以NaClO氧化NH3,反应中还原剂与氧化剂的物质的量之比为2:1,制得肼的稀溶液,反应为NaClO+2NH3
| ||
故答案为:NaClO+2NH3
| ||
(5))①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.2kJ/mol;
则17g 即1mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
| 1 |
| 4 |
故答案为:226.3kJ;
(6)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,即2NH3-6e-+6OH-═N2+6H2O,正极反应为:O2+2H2O+4e-=4OH-,依据电子守恒分析,正负极反应和生成的氢氧根离子相同,理论上分析不需要补充氢氧化钾溶液,
故答案为:2NH3-6e-+6OH-═N2+6H2O;不需要.
点评:本题考查了盖斯定律、外界条件对反应速率和平衡的影响、平衡的判断,化学平衡的计算,燃料电池等,题目难度中等,注重高考常考点的考查,注意图象变化的分析.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
 按如图所示装置,能形成原电池.下列说法正确的是( )
按如图所示装置,能形成原电池.下列说法正确的是( )| A、两烧杯中金属片表面均无气泡产生 |
| B、铜片是正极,锌片是负极 |
| C、电解质溶液一定是酸 |
| D、正极反应为:Zn-2e-═Zn2+ |
下列说法正确的是( )
| A、二氧化硫具有较强的还原性,故不能用浓硫酸干燥 |
| B、含极性键的共价化合物一定是电解质 |
| C、氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质 |
| D、天然气、酒精和液化石油气分别属于化石能源、不可再生能源和二次能源 |
下列叙述中正确的组合是( )
①酸酐一定是氧化物且是非金属氧化物
②碱性氧化物一定是金属氧化物
③不能与酸反应的氧化物一定能跟碱反应
④氧化物与水的反应都是化合反应
⑤由分子式相同的分子组成的物质一定是纯净物
⑥某化合物若含阴离子则一定含阳离子.
①酸酐一定是氧化物且是非金属氧化物
②碱性氧化物一定是金属氧化物
③不能与酸反应的氧化物一定能跟碱反应
④氧化物与水的反应都是化合反应
⑤由分子式相同的分子组成的物质一定是纯净物
⑥某化合物若含阴离子则一定含阳离子.
| A、①②⑤⑥ | B、②④⑥ |
| C、②⑥ | D、①②④⑤ |
 将如图所示实验装置的K闭合,下列判断不正确的是( )
将如图所示实验装置的K闭合,下列判断不正确的是( )| A、盐桥中K+向甲池移动 |
| B、电子沿Cu→b→a→C路径流动 |
| C、片刻后乙池中c(Cu2+)增大 |
| D、滤纸上的红点向a移动 |