题目内容
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,有关该电池的下列说法中,正确的是( )
| A、负极的电极反应式为:Al-3e-=Al3+ |
| B、该电池可以用NaOH或KOH水溶液作为电解质溶液 |
| C、该电池的电池总反应式为:2Li+FeS=Li2S+Fe |
| D、充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.Li易失电子作负极;
B.Li和水反应生成LiOH和氢气;
C.在得失电子相同的条件下,正负极电极反应式相加即得电池反应式;
D.充电时,阴极电极反应与负极反应式正好相反.
B.Li和水反应生成LiOH和氢气;
C.在得失电子相同的条件下,正负极电极反应式相加即得电池反应式;
D.充电时,阴极电极反应与负极反应式正好相反.
解答:
解:A.Li易失电子作负极,负极反应式为Li-e-=Li+,故A错误;
B.Li和水反应生成LiOH和氢气,所以电解质溶液不能是电解质的水溶液,故B错误;
C.负极反应式为Li-e-=Li+,正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应式为2Li+FeS=Li2S+Fe,故C正确;
D.充电时,阴极电极反应与负极反应式正好相反,阴极电极反应式为Li++e-=Li,故D错误;
故选C.
B.Li和水反应生成LiOH和氢气,所以电解质溶液不能是电解质的水溶液,故B错误;
C.负极反应式为Li-e-=Li+,正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,所以电池反应式为2Li+FeS=Li2S+Fe,故C正确;
D.充电时,阴极电极反应与负极反应式正好相反,阴极电极反应式为Li++e-=Li,故D错误;
故选C.
点评:本题考查了原电池和电解池原理,会正确书写电极反应式,知道原电池正负极与电解池阳极、阴极电极反应式的关系,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )
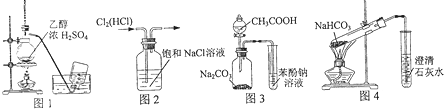

| A、利用图1装置制备乙烯 |
| B、利用图2装置除去Cl2中的HCl |
| C、利用图3装置证明酸性:CH3COOH>H2CO3>苯酚 |
| D、利用图4装置探究NaHCO3的热稳定性 |
下列说法正确的是( )
| A、所有的放热反应都能在常温常压下自发进行 |
| B、胆矾加热变为白色粉末属放热反应 |
| C、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
| D、天然气燃烧时,其化学能全部转化为热能 |
同体积、同物质的量浓度的几种可溶性盐的溶液中,一定具有相同的( )
| A、溶质的质量 |
| B、溶质的物质的量 |
| C、分子总数 |
| D、离子总数 |
下列物质的分类结果全部正确的是( )
| A、CO2--酸性氧化物 Na2O2--碱性氧化物 Al2O3--两性氧化物 |
| B、漂白粉--混合物 胆矾--纯净物 HD--化合物 |
| C、纯碱--碱 硫化氢--酸 小苏打--酸式盐 |
| D、SO2--非电解质 硫酸钡--强电解质 醋酸--弱电解质 |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是( )
| A、0.3mol NO2、0.1mol NO |
| B、0.3mol NO、0.1mol NO2 |
| C、0.6mol NO |
| D、0.3mol NO2 |
 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的NaOH溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的NaOH溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A、X点所示溶液中发生反应的离子方程式为Cl2+H2O═2H++Cl-+ClO- |
| B、Y点所示溶液中存在c(Na+)=c(HClO)+2c(ClO-) |
| C、X、Y两点所示溶液中含有微粒的种类前者多 |
| D、X、Y两点所示溶液中水的电离程度前者大 |
下列离子方程式表示正确的是( )
| A、等体积等物质的量浓度的苏打溶液和氢氧化钡溶液混合HCO3-+Ba2++OH-═BaCO3↓+H2O | ||||
B、饱和FeCl3溶液滴入沸水中继续加热:Fe3++3H2O
| ||||
| C、FeI2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||||
| D、NaHCO3的水解:HCO3-+H2O?H3O++CO32- |