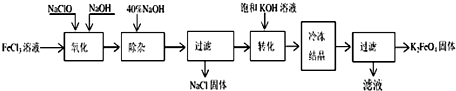
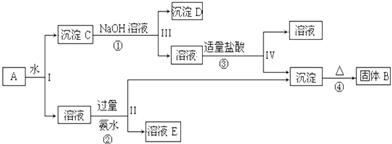
题目内容
13.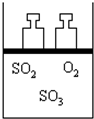 如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:
如图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A 时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c表示,回答下列问题:(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数减小(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:通入适量SO2或给体系升温.
(2)若起始时a=0.6mol,c=4.8mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时b=0.3mol.在此情况下,反应起始时将向正方向进行.
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围为3.6<c≤4.
分析 (1)恒温恒压下,通入少量O2能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,可通入适量SO2,或给体系升温使平衡逆向移动;
(2)若起始时a=0.6mol,c=4.8mol,且达到平衡后各气体的体积分数与平衡状态A相同,为等效平衡,恒温恒压下,按化学计量数完全转化到左边满足n(SO2):n(O2)=2:1;
(3)若原平衡状态A是在恒温恒容下达到的,达到的平衡状态与A相同,按化学计量数完全转化到左边满足n(SO2)=4mol、n(O2)=2mol,要使反应开始时向逆方向进行,则c应大于原平衡时三氧化硫物质的量,若二氧化硫、氧气为0时,可以确定c的最大值.
解答 解:(1)在达到平衡状态A的容器中再通入少量O2,瞬间增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,可通入适量SO2,或给体系升温使平衡逆向移动;
故答案为:减小;通入适量SO2、给体系升温;
(2)若起始时a=0.6mol,c=4.8mol,将4.8mol的转化为:a=0.6+4.8=5.4mol,b=2.4mol,要使二者物质的量之比等于起始时加入的2mol SO2和1mol O2的物质的量之比,按化学计量数完全转化到左边满足n(SO2):n(O2)=2:1,建立的平衡一定为等效平衡,5.4:(2.4+b)=2:1,所以b=0.3mol,将4molSO2和2molO2混合置于体积可变的等压容器中,平衡时总物质的量为4.2mol,而5.4molSO2和2.7molO2混合置于体积可变的等压容器中,平衡时总物质的量为$\frac{5.4}{4}$×4.2mol=5.67mol<4.8+0.6+0.3=5.7mol,所以反应起始时将向正方向进行,
故答案为:b=0.3mol;正;
(3)设原平衡中反应的氧气为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
起始(mol):4 2 0
变化(mol):2x x 2x
平衡(mol):4-2x 2-x 2x
则(4-2x)+(2-x)+2x=4.2,解得x=1.8,故原平衡时三氧化硫为3.6mol,
若原平衡状态A是在恒温恒容下达到的,达到的平衡状态与A相同,按化学计量数完全转化到左边满足n(SO2)=4mol、n(O2)=2mol,要使反应开始时向逆方向进行,则c>3.6,SO2和O2的量均为0,c有值最大时,4molSO2、2molO2完全转化可以得到4molSO3,故3.6<c≤4,
故答案为:3.6<c≤4.
点评 本题考查化学平衡计算,涉及等效平衡问题,关键是理解掌握等效平衡规律,难度中等.

 走进文言文系列答案
走进文言文系列答案| A. | SO2的催化氧化反应是吸热反应 | |
| B. | SO2的转化率一定为20% | |
| C. | 导出气体中SO3所占的体积分数为$\frac{2}{9}$ | |
| D. | 单位时间内进人接触室的气体与从接触室导出的气体的物质的量之比为10:9 |
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
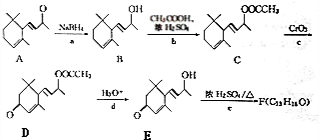
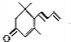 .(已知一个碳原子上不能连接两个碳碳双键)
.(已知一个碳原子上不能连接两个碳碳双键)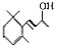 +CH3COOH$→_{△}^{浓硫酸}$、
+CH3COOH$→_{△}^{浓硫酸}$、 +H2O.
+H2O.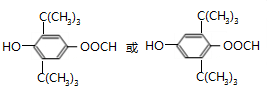
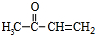 为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线.
为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线. $→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$
$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$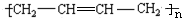 .
.