题目内容
1. 常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如图所示.下列说法正确的( )
常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如图所示.下列说法正确的( )| A. | HA是弱酸 | |
| B. | 图中未表示出的微粒的浓度小于0.1mol/L | |
| C. | 该混合溶液中:c(HA)+c(X)═c(Na+) | |
| D. | 图中M表示HA,Y表示OH-,Z表示H+ |
分析 常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,得到等量的HA、NaA的混合物,所得溶液pH>7,溶液显碱性,可知HA电离小于A-的水解,则HA为弱酸,c(HA)>0.1mol/L,c(Na+)=0.1mol/L,c(A-)<0.1mol/L,以此来解答.
解答 解:A.由上述分析可知,HA是弱酸,故A正确;
B.A-的水解生成HA,混合得到等量的HA、NaA,则c(HA)>0.1mol/L,故B错误;
C.0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合,由物料守恒可知,c(HA)+c(X)═2c(Na+),故C错误;
D.c(HA)>0.1mol/L,c(Na+)=0.1mol/L,c(A-)<0.1mol/L,c(OH-)>c(H+),则图中M表示Na+,Y表示OH-,Z表示H+,故D错误;
故选A.
点评 本题考查酸碱混合的计算,为高频考点,把握酸碱混合后溶液的溶质、水解与电离程度的判断为解答的关键,侧重分析与应用能力的考查,注意物料守恒及离子浓度的大小比较,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
19.已知HA?H++A-,常温下,对HA稀溶液加水稀释时,下列分析正确的是( )
| A. | c(OH-)减小 | B. | c(A- )增大 | C. | $\frac{c({H}^{+})}{c(HA)}$增大 | D. | pH减小 |
12.下列反应的离子方程式书写不正确的是( )
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 双氧水作脱氧剂,用于消除水中的氯气:Cl2+H2O2═2H++O2+2Cl- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
9.下列关于能源的说法不正确的是( )
| A. | 植物通过光合作用,将太阳能转化为生物质能 | |
| B. | 在农村推广建造沼气池,是对生物质能的有效利用 | |
| C. | 天然气的主要成分是甲烷,是一种可再生的清洁能源 | |
| D. | 氢能是重要的清洁能源,在蓝绿藻、微生物和太阳光作用下使水分解制氢是目前科学家研究的新方法之一 |
16.化学与社会可持续发展密切相关.下列做法不合理的是( )
| A. | 发展风能、太阳能发电 | B. | 推广煤液化、气化技术 | ||
| C. | 提倡聚碳酸酯可降解塑料的使用 | D. | 普及汞锌锰干电池的使用 |
6.下列说法正确的是( )
| A. | 乙烯可用于制取乙醇,属于水解反应 | |
| B. | 为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. |  的单体是:CH3-C≡C-CH3 和CH2=CH-CN 的单体是:CH3-C≡C-CH3 和CH2=CH-CN |
13.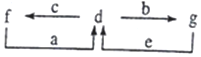 A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
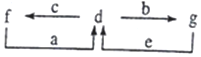 A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )| A. | 简单离子半径的大小:C>D>B | |
| B. | a中只含共价键,属于共价化合物 | |
| C. | 在水溶液中,b、g均呈酸性,c、f均呈碱性 | |
| D. | 工业上通过电解其氧化物的方法制取D的单质 |
10.下列化学用语的表示正确的是( )
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 1-丁烯的结构简式:CH3CHCHCH3 | |
| C. | HS-的水解方程式:HS-+H2O?S2-+H2O+ | |
| D. | 异丁烷的球棍模型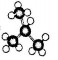 |
12.下列实验中,现象和对应结论均正确的是( )
| 选项 | 实 验 | 现 象 | 结 论 |
| A | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制 Cu(OH)2浊液,加热. | 没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| B | 分别向等浓度的Na2CO3溶液或 Na2SO4溶液中滴加酚酞试剂 | Na2CO3溶液变红色,Na2SO4溶液无明显现象 | 非金属性:S>C |
| C | 取无色溶液做焰色反应 | 焰色呈黄色 | 说明原溶液中一定不含钾元素 |
| D | 向品红溶液中滴加NaClO溶液或通入SO2气体 | 品红溶液均褪为无色 | 两者均有漂白性且原理相同 |
| A. | A | B. | B | C. | C | D. | D |