题目内容
8. 某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
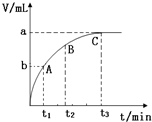
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是C.
分析 (1)过氧化氢分解生成水和氧气;
(2)时间少,则反应速率快;
(3)由图可知,曲线斜率变小,反应速率减小.
解答 解:(1)上述实验中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)时间少,则反应速率快,则实验结果表明,催化剂的催化效果与催化剂的表面积有关,故答案为:催化剂的表面积;
(3)由图可知,曲线斜率变小,反应速率减小,则A、B、C三点所表示的反应速率最慢的是C,故答案为:C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握图象及速率的影响因素为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| C. | $\frac{Kw}{c(H+)}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、AlO2- | |
| D. | 与铝反应产生大量H2的溶液中:Na+、NH4+、C6H5O-、CH3COO- |
16.某一主族元素的原子序数为x,则与其同一主族的另一元素的原子序数不可能为( )
| A. | x+10 | B. | x+26 | C. | x-34 | D. | x-24 |
3.下列有关反应限度的说法错误的是( )
| A. | 某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 | |
| B. | 可逆反应的限度不随反应条件的改变而改变 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
13.下列有关化学实验原理、操作以及现象预测和结论的叙述正确的是
 ( )
( )
 ( )
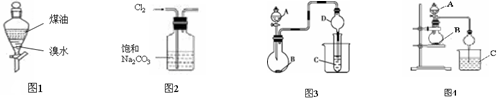
( )| A. | 利用图1完成“用煤油来萃取溴水中的Br2”,充分振荡后静置,上层变橙红色,下层几乎无色 | |
| B. | 实验室制取纯净Cl2,可用图2装置除去Cl2中的HCl气体杂质 | |
| C. | 图3中,若A、B、C分别为浓硫酸、Na2SO3固体、石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 图4中,若A为浓氨水,B为生石灰,C硝酸银稀溶液,实验中可看到C中先变浑浊后变澄清,说明AgOH具有两性 |
17.下列实验操作或由实验现象推出的结论正确的是( )
| A. | 含有1molHCl的浓盐酸与足量的MnO2反应,收集的氯气为22.4L(标准状况) | |
| B. | 含SO2的乙烯依次通入足量的NaOH溶液、酸性KMnO4溶液,可检验乙烯的还原性 | |
| C. | 制备乙酸乙酯时,将生成物通入饱和Na2CO3溶液中,除去杂质乙酸、乙醇 | |
| D. | 中和热测定实验、用温度计测量温度和搅拌,可减少热量散失 |
12.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓硫酸,Kw不变 | |
| B. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| D. | 将pH=1的强酸溶液加水稀释后,溶液中各离子的浓度均减小 |