题目内容
9.常温下,将20.0g 14.0%的NaCl溶液与30.0g 24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合液. (计算结果均须保留到小数点后面两位数字)(1)该混合溶液中溶质的质量分数;
(2)该溶液中溶质的物质的量浓度.
分析 (1)根据m(溶质)=m(溶液)×ω计算溶质的质量,计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氯化钠的质量之和计算混合后溶质氢氧化质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合液的物质的量浓度.
解答 解:(1)将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,混合后溶液的质量为:20g+30g=50g,
设混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,解得:ω=20%,
答:混合后NaCl溶液的质量分数为20%;
(2)混合后溶液中NaCl的物质的量浓度为:$\frac{1000×1.15×20%}{58.5}$mol/L=3.93mol/L,
答:混合后氯化钠溶液的物质的量浓度为3.93mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度、溶质质量分数的概念及表达式即可解答,注意掌握物质的量与溶质质量分数的关系,试题培养了学生的化学计算能力.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
17.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个进行沉淀分离,加入下列离子的先后顺序正确的是( )
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
4.白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:E(P-P)=a kJ•mol-1、E(P-O)=b kJ•mol-1、E(P=O)=c kJ•mol-1、E(O=O)=d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )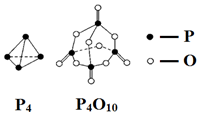

| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
14.甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l);△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ/mol
下列说法不正确的是( )
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l);△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ/mol
下列说法不正确的是( )
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
1. 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
18.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)?Y(g);(乙)A(s)+2B(g)?C(g)+D(g),当下列物理量不再发生变化时( )
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于系数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.其中能表明(甲) (乙)达到化学平衡状态有.
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于系数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.其中能表明(甲) (乙)达到化学平衡状态有.
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
8. 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;反应II的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;反应II的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.