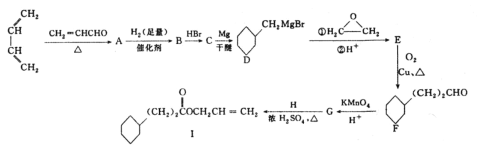
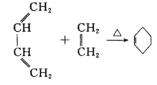
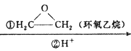
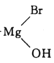
题目内容
【题目】A、B、C、D、E、F、G是前四周期元素,原子序数依次增大,根据表中提供的有关信息,回答问题:
元素 | 相关信息 |
A | 所有单质中密度最小 |
B | 形成化合物种类最多的元素 |
D | 基态原子中只有3个能级,有2个未成对电子 |
E | 短周期中原子半径最大 |
F | 第三周期中电负性最大的元素 |
G | 最外层只有一个电子,内层填满电子 |
(1)E元素在周期表中的位置是______,F元素原子最外层电子排布式为______,BD2的立体构型为______。
(2)由D、E、F三种元素形成的一种常见物质的水溶液显碱性,用离子方程式表示其显碱性的原因:______。
(3)氢化物稳定性:B______D;最高价氧化物对应的水化物酸性:C______F。(填“<”或“>”)
(4)每个B2A4分子中含有______个σ键,______个π键。
【答案】第三周期ⅠA族 3s23p5 直线型分子 ClO-+H2O![]() HClO+OH- < < 5 1
HClO+OH- < < 5 1
【解析】
A、B、C、D、E、F、G是前四周期元素,原子序数依次增大,由A的单质为所有单质中密度最小可知,A为H元素;由B元素为形成化合物种类最多的元素可知,B为C元素;由D的基态原子中只有3个能级,有2个未成对电子可知,D为O元素,C的原子序数介于碳和氧之间,则C为N元素;由E的原子半径为短周期中原子半径最大可知,E为Na元素;由F元素为第三周期中电负性最大的元素可知,F为Cl元素;由G原子最外层只有一个电子,内层填满电子可知,G为Cu元素。
(1)E为Na元素,位于元素周期表第三周期ⅠA族;F为Cl元素,氯原子最外层有7个电子,最外层电子排布式为3s23p5;BD2为二氧化碳,二氧化碳是直线形分子,故答案为:第三周期ⅠA族;3s23p5;直线形;
(2)由D、E、F三种元素形成的一种常见物质的水溶液显碱性可知,该物质为次氯酸钠,次氯酸钠是强碱弱酸盐,在溶液中水解使溶液呈碱性,水解的离子方程式为ClO-+H2O![]() HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O![]() HClO+OH-;
HClO+OH-;
(3)元素的非金属性越强,氢化物的稳定性越强,最高价氧化物对应水化物的酸性越强,氧元素的非金属性强于碳元素,则水比甲烷稳定,氯元素的非金属性强于氮元素,则高氯酸的酸性强于硝酸,故答案为:<;<;
(4)B2A4为乙烯,结构简式为CH2=CH2,碳碳双键中含有1个σ键和1个π键,则分子中含有4个碳氢σ键和1个碳碳σ键,共5个σ键和1个π键,故答案为:5;1。