题目内容
18.如图所示的实验,能达到实验目的是( )| A | B | C | D |
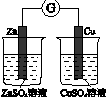 | 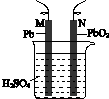 | 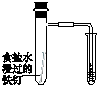 | 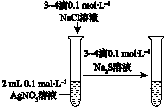 |
| 验证化学能 转化为电能 | 验证铅蓄电池 放电时Pb为负极 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度小于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.没有构成闭合回路;
B.铅蓄电池放电时Pb为负极,发生氧化反应,负极质量逐渐减少;
C.在氯化钠中性溶液中,铁发生吸氧腐蚀;
D.硝酸银过量,不能证明AgCl溶解度大于Ag2S.
解答 解:A.没有形成闭合回路,不能形成原电池,故A错误;
B.铅蓄电池放电时Pb为负极,发生氧化反应,负极质量逐渐减少,可验证铅蓄电池放电时Pb为负极,故B正确;
C.在氯化钠中性溶液中,铁发生吸氧腐蚀,应在酸性条件下发生析氢腐蚀,故C错误;
D.硝酸银过量,不能证明AgCl溶解度大于Ag2S,应在加入足量氯化钠反应的后的溶液中滴加硫化钠,故D错误.
故选:B.
点评 本题考查较为综合,涉及原电池和电解池的工作原理以及难溶电解质的溶解平衡,为高考常见题型,侧重于电解原理的考查,注意把握原电池和电解池的工作原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是( )
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)=c(Na+) |
9.下列排序正确的是( )
| A. | 离子半径:Cl-<S2-<As3- | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 热稳定性:HCl<HBr<HI | D. | 沸点:AsH3<PH3<NH3 |
6.O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究.
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
(2)为测定生成I2的量,用移液管取20.00mL反应后溶液于锥形瓶中,用 c mol•L-1的Na2S2O3标准液滴定,消耗V mLNa2S2O3溶液.
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cV g•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
| 编号 | 实验目的 | 反应物 | 反应前 溶液的pH | 温度 |
| 1 | 对照组 | O3+NaI+H2SO4 | 5.2 | 25℃ |
| 2 | ①探究FeCl2对反应速率的影响 | O3+NaI+H2SO4+FeCl2 | 5.2 | ②25℃ |
| 3 | 探究温度对反应速率的影响 | O3+NaI+H2SO4 | ③5.2 | 5℃ |
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cV g•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
13.某有机物的结构简式如图,根据乙烯、乙酸、乙醇性质类比,该物质不应有的化学性质是( )
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.
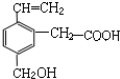
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.

| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
3.下列有关难溶电解质溶解沉淀平衡的说法不正确的是( )
| A. | 由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 | |
| B. | FeS在水中的溶解度大于在Na2S溶液中的 | |
| C. | 向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 | |
| D. | 达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
10.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物[ | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |
| B. | 反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
7.下列化学实验事实及其解释都正确的是( )
| A. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,该现象说明可用CCl4从碘水中萃取碘. | |
| B. | 向某水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明原溶液中一定含有SO42-离子 | |
| C. | 将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体 | |
| D. | 稀释浓硫酸时将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌 |
8.设NA为阿伏伽德罗常数,数值约为6.02×1023,下列说法不正确的是( )
| A. | 32g S8单质中含有的S-S键个数为6.02×1023 | |
| B. | 12.4g白磷中含有磷原子数为0.4NA | |
| C. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| D. | 0.1mol OH-含NA个电子 |