题目内容
在80g密度为d g/cm3的硫酸铁溶液中,含有2.8gFe3+离子,则此溶液中SO42-的物质的量浓度为( )A.
 dmol/L
dmol/LB.
 dmol/L
dmol/LC.
 dmol/L
dmol/LD.
 dmol/L
dmol/L
【答案】分析:2.8gFe3+离子的物质的量为 =0.05mol,根据电荷守恒可知2n(SO42-)=3n(Fe3+),据此计算n(SO42-);根据V=
=0.05mol,根据电荷守恒可知2n(SO42-)=3n(Fe3+),据此计算n(SO42-);根据V= 计算溶液的体积,再根据c=
计算溶液的体积,再根据c= 计算硫酸根的物质的量浓度.
计算硫酸根的物质的量浓度.
解答:解:2.8gFe3+离子的物质的量为 =0.05mol,
=0.05mol,
根据电荷守恒可知2n(SO42-)=3n(Fe3+)=0.05mol×3=0.15mol,
所以n(SO42-)= ×0.15mol=0.075mol.
×0.15mol=0.075mol.
80g密度为d g/cm3的硫酸铁溶液体积为 =
= ml,
ml,
所以硫酸根的物质的量浓度 =
= dmol/L.
dmol/L.
故选A.
点评:本题考查物质的量浓度计算,难度中等,根据电荷守恒或化学式判断硫酸根的物质的量是关键.
 =0.05mol,根据电荷守恒可知2n(SO42-)=3n(Fe3+),据此计算n(SO42-);根据V=
=0.05mol,根据电荷守恒可知2n(SO42-)=3n(Fe3+),据此计算n(SO42-);根据V= 计算溶液的体积,再根据c=
计算溶液的体积,再根据c= 计算硫酸根的物质的量浓度.
计算硫酸根的物质的量浓度.解答:解:2.8gFe3+离子的物质的量为
 =0.05mol,
=0.05mol,根据电荷守恒可知2n(SO42-)=3n(Fe3+)=0.05mol×3=0.15mol,
所以n(SO42-)=
 ×0.15mol=0.075mol.
×0.15mol=0.075mol.80g密度为d g/cm3的硫酸铁溶液体积为
 =
= ml,
ml,所以硫酸根的物质的量浓度
 =
= dmol/L.
dmol/L.故选A.
点评:本题考查物质的量浓度计算,难度中等,根据电荷守恒或化学式判断硫酸根的物质的量是关键.

练习册系列答案
相关题目
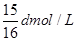 B.
B.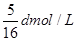
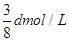 D.
D.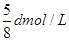
 dmol/L
dmol/L dmol/L
dmol/L dmol/L
dmol/L dmol/L
dmol/L