题目内容
某反应物和生成物是AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物X.
(1)已知KBrO3在反应中得到电子,该反应中的还原剂是 ;
(2)已知0.2mol的KBrO3在反应中得到1mol的电子生成X,则X的化学式是 ;
(3)写出该反应配平的化学方程式并用单线桥法表示其电子转移方向和总数: .
(1)已知KBrO3在反应中得到电子,该反应中的还原剂是
(2)已知0.2mol的KBrO3在反应中得到1mol的电子生成X,则X的化学式是
(3)写出该反应配平的化学方程式并用单线桥法表示其电子转移方向和总数:
考点:氧化还原反应
专题:氧化还原反应专题
分析:由给出的物质可知,KBrO3在反应中得到电,Br元素的化合价降低,As元素的化合价升高,发生KBrO3+H2SO4+AsH3→H3AsO4+K2SO4+H2O+X,
(1)失电子化合价升高的反应物是还原剂;
(2)0.2mol的KBrO3在反应中得到1mol的电子生成X,根据溴酸钾和转移电子之间的关系确定X;
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-.
(1)失电子化合价升高的反应物是还原剂;
(2)0.2mol的KBrO3在反应中得到1mol的电子生成X,根据溴酸钾和转移电子之间的关系确定X;
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-.
解答:
解:由给出的物质可知,KBrO3在反应中得到电,Br元素的化合价降低,As元素的化合价升高,发生KBrO3+H2SO4+AsH3→H3AsO4+K2SO4+H2O+X,
(1)该反应中As元素化合价由-3价变为+5价,所以失AsH3是还原剂,故答案为:AsH3;
(2)0X中溴元素的化合价为x,由电子守恒可知,0.2mol×(5-x)=1mol,解得x=0,所以X的化学式为Br2,故答案为:Br2;
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-,其表示为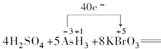 ,故答案为:
,故答案为: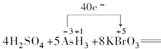 .
.
(1)该反应中As元素化合价由-3价变为+5价,所以失AsH3是还原剂,故答案为:AsH3;
(2)0X中溴元素的化合价为x,由电子守恒可知,0.2mol×(5-x)=1mol,解得x=0,所以X的化学式为Br2,故答案为:Br2;
(3)化合价升高的元素是砷元素,化合价从-3价升到+5价,化合价降低的元素是溴元素,化合价从+5价降到0价,化合价升高和降低数目得相等,所以转移40e-,其表示为
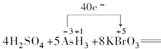 ,故答案为:
,故答案为: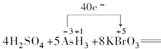 .
.
点评:本题考查了氧化还原反应,明确元素化合价是解本题关键,再结合转移电子守恒分析解答,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列离子方程式正确的是( )
| A、氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | ||||
| B、在AgCl沉淀中加入碘化钾溶液:AgCl(s)+I-(aq)═AgI (s)+Cl-(aq) | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
D、电解氯化镁溶液:2Cl-+2H2O
|
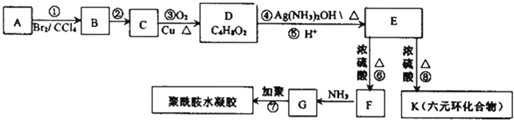
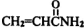 )具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.
)具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.